
| A. | NaOH | B. | NaHCO3 | C. | CH3COONa | D. | Na |
分析 醋酸溶液中存在电离平衡CH3COOH?CH3COO-+H+,欲使醋酸溶液中的CH3COO-浓度增大,电离平衡向电离方向移动,且不放出气体,依据选项和平衡移动原理分析,
A.氢氧化钠加入会中和氢离子平衡正向进行;
B.加入碳酸氢钠和氢离子反应生成二氧化碳气体;
C.加入醋酸钠,溶液中醋酸根离子浓度增大平衡逆向进行;
D.加入钠和氢离子反应生成氢气,平衡正向进行;
解答 解:A.醋酸溶液中存在电离平衡CH3COOH?CH3COO-+H+,加入氢氧化钠固体溶解后发生反应H++OH-=H2O,电离平衡正向进行,醋酸根离子浓度增大,反应过程中无气体生成,故A正确;
B.加入NaHCO3固体溶解后发生反应,HCO3-+H+=H2O+CO2↑,平衡正向进行醋酸根离子浓度增大,但有气体生成,故B错误;
C.加入CH3COONa溶解后溶液中醋酸根离子浓度增大,平衡逆向进行,故C错误;
D.加入钠是活泼金属,和溶液中氢离子反应生成氢气,平衡正向进行,故D错误;
故选B.
点评 本题考查了弱电解质电离平衡的影响因素分析判断,主要是溶液中离子浓度变化的理解应用,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
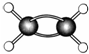 科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质.
科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质. 代表氢原子,
代表氢原子, 代表碳原子)和水,该有机物的结构简式为CH2=CH2.
代表碳原子)和水,该有机物的结构简式为CH2=CH2.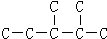 ,该烷烃的名称为2,3-二甲基戊烷;其一溴代物有6种.
,该烷烃的名称为2,3-二甲基戊烷;其一溴代物有6种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘-127和碘-131的核外电子数之比为127:131 | |
| B. | 碘-127和碘-131的核内中子数之比为127:131 | |
| C. | 碘-127和碘-131的核内中子数与质子数之差的比值为1:1 | |
| D. | 碘-127和碘-131的核内质子数与核外电子数之和的比值为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )易溶于水,常用做汽水,糖果的添加剂.下列有关说法中,正确的是( )
)易溶于水,常用做汽水,糖果的添加剂.下列有关说法中,正确的是( )| A. | 苹果酸属于烃 | B. | 苹果酸中有3种官能团 | ||
| C. | 苹果酸的分子式是C3H6O5 | D. | 苹果酸能使紫色石蕊溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
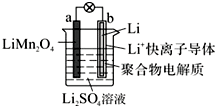
| A. | 充电时,a为阴极 | |
| B. | 充电时,溶液中Li+从b向a迁移 | |
| C. | 电池放电时负极反应为Li-e-═Li+ | |
| D. | 利用该电池电解水,消耗锂14 g可生成气体33.6 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入含HClO的溶液中生成H2SO4,酸性:HClO>H2SO4 | |
| B. | 铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝熔点高于铝 | |
| C. | SiO2可以和NaOH溶液及HF溶液反应,SiO2属于两性氧化物 | |
| D. | SO2使溴水褪色,SO2具有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com