
【题目】将64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为22.4 L。请计算(写出计算过程):
(1)NO标况下的体积________
(2)参加反应的HNO3的物质的量________。
【答案】设NO标况下的物质的量为xmol,NO2标况下的物质的量为ymol
x+y=![]()
3x+y=![]() ×2
×2
解得:x=0.5,y=0.5
NO在标况下的体积为0.5×22.4=11.2L 参加反应的HNO3的物质的量为![]() ×2+
×2+![]() =3mol
=3mol
【解析】
本题考查氧化还原反应的计算,物质的量浓度的计算,可根据电子得失守恒及元素守恒列方程式解即可。
(1)64g的物质的量![]() ,在反应中失去电子的物质的量是
,在反应中失去电子的物质的量是![]() ,22.4L混合气体的物质的量
,22.4L混合气体的物质的量![]() ,设NO标况下的物质的量为xmol,NO2标况下的物质的量为ymol
,设NO标况下的物质的量为xmol,NO2标况下的物质的量为ymol
元素守恒:x+y=![]()
电子得失守恒:3x+y=![]() ×2
×2
解得:x=0.5,y=0.5
NO在标况下的体积为0.5mol×22.4L/mol=11.2L。故正确答案为:
解:设NO标况下的物质的量为x mol,NO2标况下的物质的量为y mol
x+y=![]()
3x+y=![]() ×2
×2
解得:x=0.5,y=0.5
NO在标况下的体积为0.5mol×22.4L/mol=11.2L。
(2)参加反应的硝酸的物质的量是酸性的硝酸根和氧化性的硝酸的物质的量之和,即![]() ×2+
×2+![]() =3mol,故正确答案为:参加反应的HNO3的物质的量为
=3mol,故正确答案为:参加反应的HNO3的物质的量为![]() ×2+
×2+![]() =3mol。
=3mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以环己醇![]() 制备环己烯。已知:
制备环己烯。已知:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
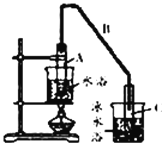
①写出环己醇制备环己烯的化学反应方程式:_________。
②A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_____________。
③试管C置于冰水浴中的目的是_______________________。
(2)环己烯粗品中含有环己醇和少量酸性杂质等,需要提纯。
①加入饱和食盐水,振荡、静置、分层,水在______层(填上或下);分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环己烯热馏,蒸馏时要加入生石灰,目的是__________。
③收集产品时,控制的温度应在_________左右。
(3)以下区分环己烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10 mL 0.40 mol·L-1 H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.反应到6 min时,c(H2O2)=0.30 mol·L-1
B.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2 mol·L-1·min-1
C.6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol·L-1·min-1
D.反应到6 min时, H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.Zn+H2SO4=ZnSO4+H2↑;B.NaOH+HCl=NaCl+H2O。能设计成原电池的反应是__________(填“A”或“B”)。
(2)将锌片和铜片按如图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置
B.甲中铜片质量减少、乙中锌片质量减少
C.两烧杯中溶液的c(H+)均减小
②在相同时间内,两烧杯中产生气泡的速度:甲__________乙(填“>”、“<”或“=”)。
③请写出图中构成原电池的正极电极反应式:__________。
④当乙中产生2.24 L(标准状况)气体时,将锌铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.2 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素符号、结构示意图、电子式、结构式等通常叫做化学用语,下列化学用语错误的是( )
A.CO2分子的电子式为:![]()
B.NaOH的电子式为:![]()
C.Cl-的结构示意图为: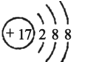
D.HClO的结构式为:H-Cl-O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国部分地区水资源缺乏,海水淡化是永恒的话题。下列有关海水淡化的说法错误的是
A.如图制备蒸馏水方法技术成熟,但是成本太高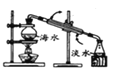
B.如图制备蒸馏水的过程,利用了清洁能源太阳能,且可分离出海水中的盐类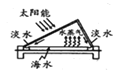
C.如图是离子交换法制备淡水,在阴阳离子交换后发生了酸碱中和反应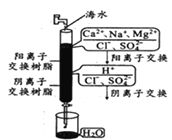
D.如图在阳离子交换过程中阳离子数目保持不变,溶液酸碱性也保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用相应的化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符号为________;M在元素周期表中的位置为________________。
(2)X与Y按原子个数比1∶1构成的物质的电子式为________________;所含化学键类型__________________________。
(3)X+、Y2-、M2-离子半径大小顺序为__________________。
(4)将YM2通入FeCl3溶液中的离子方程式:_________________________________________。
Ⅱ.如图转化关系(A、B、C中含相同元素)
![]()
![]()
![]()
![]()
![]()
(1)若B为白色胶状不溶物,则A与C反应的离子方程式为_________________________。
(2)若向B溶液中滴加铁氰化钾溶液会产生特征蓝色沉淀,则A与C反应生成B的离子方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确且与对应操作和目的相符的是
选项 | 目的 | 操作 | 离子方程式 |
A | 比较Fe2+和Br还原性强弱 | 向FeBr2溶液中滴入少量氯水 | 2Br+Cl2=Br2+2Cl |
B | 比较C、Si非金属性强弱 | 向硅酸钠溶液中通入少量二氧化碳 | SiO32-+CO2+H2O=H2SiO3↓+CO32- |
C | 除去CO2中的SO2 | 将气体通入盛有饱和碳酸氢钠溶液的洗气瓶 | CO32-+SO2= SO32-+CO2 |
D | 实验室制取氯气 | 向MnO2固体中加入浓盐酸并加热 | MnO2+4HCl(浓) +2Cl +Cl2↑+2H2O |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com