
【题目】下列有关物质用途的叙述中,错误的是
A. 水玻璃是制取水泥的原料
B. 二氧化硅是制造光导纤维的材料
C. 硅是制造太阳能电池的常用材料
D. 纤维常用做复合材料的增强体
科目:高中化学 来源: 题型:
【题目】一定温度下,把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:3A(g)+B(s)![]() x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
A. 反应达到平衡状态时A的转化率为60%
B. x=4
C. 反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为6∶5
D. 若混合气体的密度不再变化,则该可逆反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是:
A. 光导纤维主要成分是二氧化硅,属于传统无机非金属材料
B. 汽车尾气是造成城市大气污染的重要原因之一
C. 为了延长食品保质期,应加大防腐剂的使用量
D. 食盐中加碘酸钾的目的是防止氯化钠变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果用0.3 mol·L1的亚硫酸钠溶液16mL,恰好将3.2×103mol的强氧化剂[RO(OH)2]2+溶液的溶质还原到较低价态。则反应后R的最终价态为
A. 0 B. +1 C. +2 D. +3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,已知两瓶容积相同,同温同压下,左瓶内充满氯化氢气体,当右瓶中充满下列混合气体中的某一组时,其所含原子总数与左瓶中所含原子总数一定相等,则该混合气体是( )

A. O3、N2 B. CH4、NH3 C. N2、O2 D. CO、CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠有少量泄漏,可通过喷洒硫代硫酸钠溶液来处理,以减轻污染。某化学兴趣小组在实验室制备硫代硫酸钠,并探究硫代硫酸钠的性质及氰化钠废水的处理。
【实验一】实验室通过如下图(a)所示装置制备Na2S2O3·5H2O
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示,
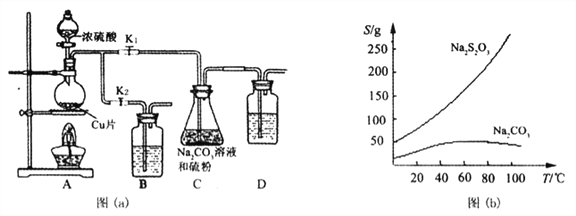
步骤1:如图连接好装置后,检查A、C装置气密性的操作是__________。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列__________(填编号)
A. NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH在7至10时,打开K2、关闭K1并停止加热,C中溶液要控制pH的原因是__________。
步骤4:先将C中的混合液过滤,再将滤液经过加热浓缩,趁热过滤,最后将滤液__________得到产品。
【实验二】Na2 S2O3的性质及废水处理:
(1)向足量的新制氯水中滴加少量Na2 S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的离子方程式__________。
(2)氰化钠与硫代硫酸钠的反应为:NaCN + Na2S2O3=NaSCN + Na2SO3;已知:NaSCN中S为-2价,处理掉lmolNaCN,碳原子失去电子的物质的量为__________。
(3)废水中的CN-也可在催化剂作用下先用NaClO氧化成CNO-,再在酸性条件下继续用NaClO将CNO-氧化成两种对环境无污染的气体。则后一步反应的离子方程式为:
__________。
三、计算题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素的部分性质数据如下:
元素 | T | X | Y | Z | W |
原子半径(nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
请回答下列问题:
(1)Z离子的结构示意图为________________。
(2)关于Y、Z两种元素,下列叙述正确的是________(填序号)
a.简单离子的半径Y>Z
b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物。
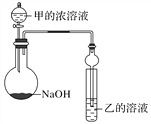
某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中立即有甲放出,原因是______________________。
一段时间后,观察到试管中的现象是______________________________,发生反应的离子方程式是______________________________________________。
(4)XO2是导致光化学烟雾的“罪魁祸首”之一。它被NaOH溶液吸收的化学方程式是:2XO2+2NaOH===M+NaXO3+H2O(已配平),产物M中元素X的化合价为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)决定物质体积的因素有 ①构成物质的粒子数;②粒子大小;③粒子间的距离。对固体、液体物质而言,它主要是由上述______决定(填写编号,下同);对气体物质而言,它主要由上述_____决定。
(2)标准状况下,体积为11.2 L 的CO2的 质量______g,其所含原子的总数是______ 个。
(3)配制100 mL2 molL-1的H2SO4溶液,需要某98%H2SO4溶液(密度为1.8g/cm-3)的体积为________ml(保留三位有效数字)。取配制后的溶液20ml,SO42-的物质的量为______,加入足量的锌,生成标况下氢气的体积为:______ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A、C、D均为无色气体,且气体C的水溶液显碱性。

(1)用化学用语按要求填空:
X的化学式为:__________,X中含有化学键类型为__________;A的电子式__________。
(2)写出反应②的离子方程式___________________________。
(3)过量的Fe粉与G的稀溶液反应,向反应后溶液中加入碱溶液,现象是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com