
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向蔗糖中加入浓硫酸,搅拌得黑色海绵状固体,并放出刺激性气味气体 | 浓硫酸仅体现吸水性和脱水性 |
B | 向蓝色石蕊试纸上滴加新制氯水,试纸边缘呈红色,中间为白色 | 氯水既有酸性又有还原性 |
C | 卤代烃Y与NaOH溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀 | 卤代烃Y中含有氯原子 |
D | 取5 mL 0.1 mol·L-1KI溶液,加入1 mL 0.1 mol·L-1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色 | Fe3+与I-所发生的反应为可逆反应 |
A. A B. B C. C D. D
【答案】CD
【解析】
A. 蔗糖中加入浓硫酸得黑色的炭,说明浓硫酸具有脱水性,放出的刺激性气味气体是SO2,说明浓硫酸具有强氧化性:C+2H2SO4(浓)![]() CO2↑+SO2↑+2H2O,A项错误;
CO2↑+SO2↑+2H2O,A项错误;
B. 试纸边缘呈红色,说明氯水显酸性;液滴中间为白色,说明液滴中间的HClO浓度大,HClO漂白了试纸,说明氯水具有漂白性。B项错误;
C.卤代烃在NaOH溶液中发生水解反应R-X+NaOH![]() R-OH+NaX,加入足量稀硝酸中和过量的NaOH后,再加入AgNO3溶液Ag++X-=AgX↓生成的白色沉淀是AgCl,所以Y为氯代烃,C项正确;
R-OH+NaX,加入足量稀硝酸中和过量的NaOH后,再加入AgNO3溶液Ag++X-=AgX↓生成的白色沉淀是AgCl,所以Y为氯代烃,C项正确;
D.有反应2I-+2Fe3+=I2+2Fe2+, 5 mL 0.1 mol·L-1KI溶液与1 mL 0.1 mol·L-1FeCl3溶液中物质的量之比n(KI):n(FeCl3)≈5:1,说明KI过量,如果该反应是不可逆反应,则混合后溶液中没有Fe3+,萃取分液后的水层中加入KSCN溶液,溶液不会变红,但事实上溶液变红,所以Fe3+与I-所发生的反应为可逆反应,D项正确;答案选CD。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。

(1)由图中的数据分析,该反应的化学方程式为____________________________________________
(2)反应开始至2min、5minZ的平均反应速率为__________________、_______________;
(3)5min后Z的生成速率比5min末Z的 生成速率___________(大、小、相等)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组测定硫铁矿(主要成分FeS2)矿样中硫元素的质量分数,进行如下实验:将m1g样品放入如图所示装置C中,打开K1关闭K2,从a处不断通入空气,高温灼烧石英管中的样品。

请回答下列问题:
(1)装置B的名称为_____;a处不断通入空气的目的是_____。
(2)装置A的作用是_____。
(3)反应结束后,关闭K1打开K2,向烧瓶中加入液体,点燃G处酒精灯,使烧瓶中反应发生,操作流程如图。

①操作I所得溶液中所含的溶质有_____。
②操作Ⅱ是洗涤、烘干、称重,检验固体是否洗净的方法是_____。
③该硫铁矿中硫元素的质量分数为_____(用含m1、m2的代数式表示)
(4)取煅烧后的熔渣(含有Fe2O3、FeO),欲验证其中存在FeO,应选用的试剂是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R为五种短周期主族元素,且原子序数依次增大,X与W同主族,Z与R同主族,X的原子半径比Y的小,Y的最高价氧化物对应的水化物是强酸,Z的最外层电子数是其内层电子数的3倍。下列说法正确的是
A. 原子半径:r(W)>r(Z)>r(Y)
B. 简单气态氢化物的热稳定性:Y>Z
C. R的氧化物对应的水化物均为强酸
D. W2Z2与X2R均含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.050 0 mol·L-1H2C2O4溶液所得滴定曲线如图所示。下列关于溶液中微粒的物质的量浓度关系一定正确的是

A. 在整个滴定过程中,始终存在:c(H+)+ c(Na+) =c(OH-)+c(C2O42-)+ c(HC2O4-)
B. 当V[NaOH(aq)]=10.00 mL时:c(Na+)> c(HC2O4-)>c(C2O42-)> c(H2C2O4)
C. 当V[NaOH(aq)]=15.00 mL时:3c(Na+)= 2c(C2O42-)+ 2c(HC2O4-)+2c(H2C2O4)
D. 当 V[NaOH(aq)]=30.00 mL时:c(C2O42-)+2c(HC2O4-)+3c(H2C2O4)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。
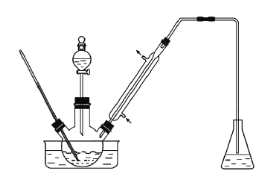
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1) 实验装置中冷凝管的主要作用是___________________。
(2) 步骤1所加入的物质中,有一种物质是催化剂,其化学式为__________________
(3) 写出由苯甲醛制取间溴苯甲醛的化学方程式_____________________________________________________
(4) 为防止污染环境,锥形瓶中盛装的溶液应该是______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+ (aq) + Cu(s) == Cu2+ (aq) + 2Ag (s)设计的原电池如下图。

请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是_____________;
(2)银电极为电池的_________极;银电极上发生的电极反应式______________。
(3)外电路中的电子是从________电极流向______电极(填电极的材料)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向V L密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:
2NO(g)+C(s)![]() N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
温度/℃ | n (C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是
A. 由上述信息可推知:T1 > T2
B. T2℃时,若反应达平衡后再缩小容器的体积,c (N2):c (NO)增大
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D. T1℃时,该反应的平衡常数![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com