
����Ŀ��
��1������������Ҫ��ȡNaOH���� g��
��2������ʱ������ʹ�õ����������� ������ţ���
��3������ʱ������ȷ�IJ���˳���ǣ�������ű�ʾ��ÿ������ֻ��һ�Σ� ��
�� ������ˮϴ���ձ�2 ~ 3�Σ�ϴ��Һ��ע������ƿ����
�� ��ʢ��NaOH������ձ��м�������ˮ�ܽ�
�� ���ձ�������ȴ����Һ�ز�����ע������ƿ��
�� ������ƿ�ǽ����������µߵ���ҡ��
�� ���ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
�� ����������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1 ~ 2cm��
��4��������������������н�����������ҺŨ��ƫ�ߵ��� �������б�ţ���
������ƿʵ��ǰ������ˮϴ�ɾ�����δ��� �����ݹ۲�Һ��ʱ����
���ܽ���������ʷ��ȣ�û�е����������� ��������ˮʱ���������˿̶�
��5������ƿ��������__________(���������)��
�� ����һ�����ȷŨ�ȵı���Һ
�� ������Һ
�� ��������ƿ������µ����������Һ��
�� ȷϡ��ijһŨ�ȵ���Һ
�� ���������ܽ��������
II.����6�֣�ij��ѧС���Ա�����Ϊԭ�ϣ���ȡ�������������֪�й����ʵķе����±���
���� | �״� | ������ | ��������� |
�е�/�� | 64.7 | 249 | 199.6 |
��1��������λͬѧ�ֱ����������ͼ��ʾ������ʵ���Һϳɱ����������װ��(�г������ͼ�������������ȥ)�������л���ķе㣬��ò���______(����������������)װ�á������� ��
��2��ʵ����Ũ�����������________________��
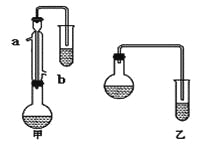
��3����Ӧ��CH3OHӦ������������ ��
��4������������ֲ�Ʒ���������������״����������ˮ�ȣ���������������ͼ���о��ƣ���������ͼ�з�����������������������ơ�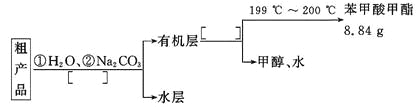
���𰸡�I������10�֣�
��1��20.0��
��2���٢ۢݢޢ���
��3���ڢۢ٢ޢݢ���
��4���ڢ���
��5���ڢۢܢ�
II. ����6�֣�
��1�� �ף���������������װ�ã�
��2����������ˮ����
��3��Ϊ����߱���������IJ��ʣ�
��4����Һ������
�����������������I����1������0.5molL-1��NaOH��Һ600mL��Ӧѡ��1000mL����ƿ����Ҫ���ʵ�����=0.5molL-1��1.0L��40g/mol=20.0g���ʴ�Ϊ��20.0��
��2������һ�����ʵ���Ũ��һ�㲽�裺���㣬�������ܽⲢ��ȴ��ϴ�Ӳ�ת�ƣ�����ҡ�ȣ��õ��������У�������ƽ���ձ�����������500mL����ƿ����ͷ�ιܣ�����ʹ�õ������У��٢ۢݢޢ����ʴ�Ϊ���٢ۢݢޢ���
��3������һ�����ʵ���Ũ��һ�㲽�裺���㣬�������ܽⲢ��ȴ��ϴ�Ӳ�ת�ƣ�����ҡ�ȣ�������ȷ��˳��Ϊ���ڢۢ٢ޢݢ����ʴ�Ϊ���ڢۢ٢ޢݢ���
��4��������ƿʵ��ǰ������ˮϴ�ɾ�����δ��ɣ������ʵ����ʵ�������Һ�������Ӱ�죬��ҺŨ�Ȳ��䣬�ʲ�ѡ��
�����ݹ۲�Һ��ʱ���ӣ�������Һ���ƫС����ҺŨ��ƫ��ѡ��
���ܽ���������ʷ��ȣ�û�е����������ã��������ʵ����ƫС����Һ��Ũ��ƫ��ѡ��
��������ˮʱ���������˿̶ȣ�������Һ���ƫ����ҺŨ��ƫ�ͣ��ʲ�ѡ����ѡ���ڢ���
��5������ƿ����������һ�����ȷŨ�ȵı���Һ������ƿ��������������Һ������ƿֻ��һ���̶ȣ����ܲ�������ƿ������µ����������Һ�壻����ȷϡ��ijһŨ�ȵ���Һ���������������ܽ�������ʣ���ѡ�ڢۢܢ���
II. ��1����װ��ͼ��֪����ͼ��Բ����ƿ���������ܣ�����������ã���ͼû�У��������з�Ӧ��״��е�ͣ������ᡢ����������ķе�Զ���ڼ״�����������ͼ���״��ض�������ӷ��������ںϳɷ�Ӧ������Ӧ�������������ټ״��Ļӷ�����߲��ʣ��ʴ�Ϊ���ף� ��������������װ�ã�
��2��Ũ������������Ӧ�����˴������ã�������ӦΪ���淴Ӧ��Ũ�������շ�Ӧ���ɵ�ˮ�����Դٽ��������ɣ�Ũ����������ˮ�������ã��ʴ�Ϊ����������ˮ����
��3�����ڸ÷�Ӧ�ǿ��淴Ӧ���״��ȱ�����������Ҽ״��е�ͣ�����ʧ�����Ӽ״�����������߱���������IJ��ʣ��ʴ�Ϊ����߱���������IJ��ʣ�
��4�����������������ˮ��������������������ܵ�Һ�壬ͨ�����÷�Һ������ɣ��״��ͱ����������ܽ⣬���߷е㲻ͬ������ͨ������������룬�ʴ�Ϊ����Һ������


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl3���ִ���ҵ������Ӧ�ù㷺�����������ϵ�֪����ˮFeCl3�ڿ������׳��⣬��������������ҵ�ϣ���500��600�����м��ͨ��������������ˮ�Ȼ������������м��ͨ���Ȼ������������ˮ�Ȼ�������ij��ѧ�о���ѧϰС��ģ�ҵ���������Ʊ���ˮFeCl3���Բ�����������̽��ʵ������ش��������⣺
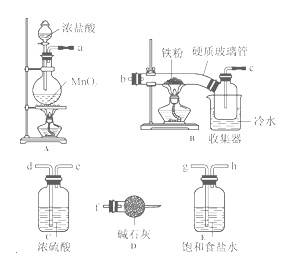
��1��װ�õ�����˳��Ϊa �� ����b��c��h��ʾ����
��2��i��A��װ�������Լ��鷽�� ��
ii��D�м�ʯ�ҵ������� ��
��3����Ӧ���������ɵ���״FeCl3�ֽ����ռ��������������ڷ�Ӧ��B��Ӳ�ʲ����ܵ��Ҷˡ�Ҫʹ������FeCl3�����ռ���������еIJ����� ��
��4����Ӧһ��ʱ���Ϩ��ƾ��ƣ���ȴ��Ӳ�ʲ����ܼ��ռ����е�����һ������ת������ƿ�У����������ϡ���������ֲ��������Ӧ�����в���������ַ�Ӧ��������ʵ�飺
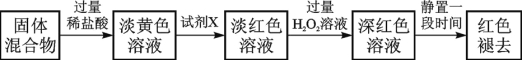
��֪��ɫ��ȥ��ͬʱ���������ɣ�������ΪO2����С��ͬѧ�Ժ�ɫ��ȥ��ԭ�����̽����
��ȡ��ɫ����Һ���ݣ���һ�ݵμ�FeCl3��Һ�����Ա仯���ڶ��ݵμ��Լ�X����Һ���ֺ�ɫ�������ݵμ�ϡ�����BaCl2��Һ��������ɫ������
����ȡͬ���ʵ���Ũ�ȵ� FeCl3��Һ�μ�2���Լ�X����Һ��죬��ͨ��O2�������Ա仯��
ʵ���˵�� ��
ʵ��ڵ�Ŀ���� ��
�ó����ۣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��Ҫ���뻹ԭ������ʵ�ֵ���
A. MnO4����MnO2 B. H2SO4 ��H2 C. Al3+��AlO2- D. Al��Al3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ��������ɢ�NH4Cl����AlCl3����NaCl����AgNO3����KOH�е�һ�ֻ�����ɣ��˹���Ͷ��ˮ�еó�����Һ������Һ��ʹ��̪�ʺ�ɫ��������Һ�м�ϡ���ᵽ�������а�ɫ�������������ԭ������жϲ���ȷ����
A���϶����ڢ� B�����ٴ��ڢں͢�
C����ȷ���Ƿ��Т� D�����ٴ��ڢ١��ܡ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PHB��֬�ɱ����オ�⣬�Ի����Ѻã��л���F��ҽҩ�ϳ��м��塣���ǵĺϳ�·�����£�
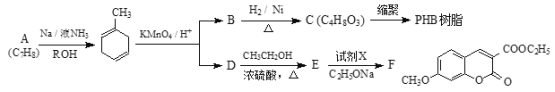
��֪����![]()
��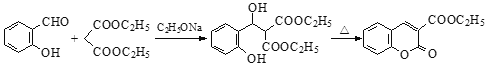
��1��������C������������___________��
��2��D��E�Ļ�ѧ����ʽΪ______________________________��
��3��B��C�ķ�Ӧ������____________���Լ�X�Ľṹ��ʽ�� ��
��4���ɻ�����C�ϳ�PHB��֬�Ļ�ѧ����ʽ��___________________________��
��5��д����������������E������ͬ���칹��Ľṹ��ʽ��________________��
a. �˴Ź���������2��壻b. ����NaHCO3��Һ��Ӧ���ܷ���ˮ�ⷴӦ���ɶ�Ԫ���ᡣ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��¡����������£���ʹA��g��+B��g��C��g��+D��s�� ����Ӧ��������Ĵ�ʩ�ǣ�������
A.��СC��D��Ũ��
B.�ټ���һ����D
C.��СB��Ũ��
D.����A��B��Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪
Fe(s)��CO2(g)![]() FeO(s)��CO(g) K1 ��
FeO(s)��CO(g) K1 ��
Fe(s)��H2O(g)![]() FeO(s)��H2(g) K2 ��
FeO(s)��H2(g) K2 ��
H2(g)��CO2(g)![]() H2O(g)��CO(g)K3 ��
H2O(g)��CO(g)K3 ��
����֪��ͬ�¶��£�K1��K2ֵ���ұ���
�¶�/�� | K1 | K2 |
500 | 1.00 | 3.15 |
700 | 1.47 | 2.26 |
900 | 2.40 | 1.60 |
��1���жϷ�Ӧ���ﵽ��ѧƽ��״̬��������____________��
a����������ƽ��Ħ����������
b�����������c(CO)����
c��v(H2O)����v(H2)��
d������2 mol H��O����ͬʱ����1 mol H��H��
��2����500 ��ʱ���з�Ӧ����CO2��ʼŨ��Ϊ2 mol��L��1,2���Ӻ���ƽ�⣬��CO2ת����Ϊ________����CO��ʾ������Ϊ________________��
��3������ͼ���Ϸ�Ӧ������___________(�����)(ͼ��v�����ʣ���Ϊ�������H2������ٷֺ���)��
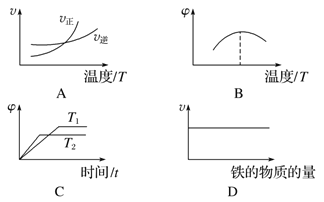
��4��900 �����з�Ӧ������ƽ�ⳣ��K3Ϊ____________(�������ֵ)���ʱ���H__________0(����>������������<��)�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ�Ӧ����ʽΪ�� ��
A��NH4HCO3���ڹ�����ŨKOH��Һ�У�NH4+ +OH���TNH3��+ H2O
B�������ȥˮ����2H++CaCO3�TCa2++CO2��+H2O
C����FeBr2��Һ��ͨ������������2Fe2++4Br��+3Cl2�T2 Fe3++2Br2+6 Cl��
D��������[KAl(SO4)2 12H2O]��Һ�еμ�Ba��OH��2��Һ��ǡ��ʹSO42��������ȫ��
2Al3++3SO42��+3Ba2++6OH ���T2 Al��OH��3��+3BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ýӴ�����ȡ��������У��������ڷ���¯��ȼ�յĻ�ѧ����ʽ��__________���÷�Ӧ����������________����ԭ����________����������Ԫ����________������ԭ��Ԫ����________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com