
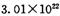 个 B原混合物:
个 B原混合物: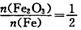
 D .所得溶液:
D .所得溶液:
科目:高中化学 来源:不详 题型:填空题
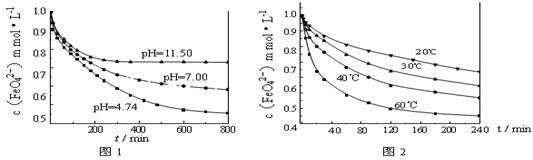
 4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。
4 Fe(OH)3+8OH-+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀H2SO4 | B.CuSO4溶液 | C.AgNO3溶液 | D.Fe2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.往溶液中滴入无色的KSCN溶液,不显红色 |
| B.Fe2+和Fe3+的物质的量比为6∶1 |
| C.反应中氧化产物和还原产物的物质的量比为2∶1 |
| D.铁粉有剩余,溶液浅绿色,Cl-的浓度基本保持不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.4g | B.3.36g | C.5.60g | D.6.4g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
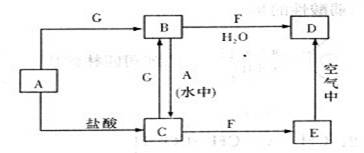
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 探究内容 | 实验方案 | 实验现象 | 写出下列离子方程式 |
| 探究Fe2+具有还原性 | 取少量0.1mol·L-1FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量 | 溶液先不变红, 后变为血红色 | ①Fe2+发生的反应: |
| 探究Fe3+具有氧化性 | 取少量0.1mol·L-1FeCl3溶液,加入足量 后,再往溶液中加入少量KSCN溶液 | 溶液不变为血红色 | ②Fe3+发生的反应: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com