
[化学——选修 3:物质结构与性质](15分)W、Q、R、X、Y、Z六种元素的原子序数逐渐增大。已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为msnMpn。请回答下列问题:
(1)Q和W能形成一种化合物的相对分子质量为28,则该化合物的中心原子采取的杂化轨道类型是 _______,该分子中含有____个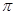 键。
键。
(2)Z原子的核外电子排布式为 _______;向Z的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体中Z的离子与NH3之间的化学键为_______。
(3)这六种元素中,电负性最大与最小的两种非金属元素形成的晶体属于____晶体;Q、R、X三种元素的第一电离能数值由小到大的顺序为 _______(用元素符号回答)。
(4)元素X的阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元如图所示。
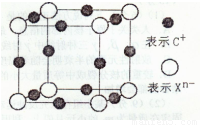
该晶体中阳离子和阴离子个数比为____,晶体中每个Xn-被_______ 个等距离的C+离子包围。
科目:高中化学 来源: 题型:
| 3 |
| ||
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?辽宁一模)[化学--选修3物质结构与性质]
(2013?辽宁一模)[化学--选修3物质结构与性质]| 417×1030 |
| a3NA |
| 417×1030 |
| a3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com