
 钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断该钙的氧化物的化学式为
钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示,由此可判断该钙的氧化物的化学式为| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| m |
| V |
| ||
| V |
| 3 |
| ||
| ||
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| m |
| V |
| ||
| V |
| 3 |
| ||
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CO32-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水.实验室可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,易溶于水.实验室可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4[ |
| 沉淀完全pH | 13 | 14 | 3.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用氨水鉴别MgCl2溶液和AlCl3溶液 |
| B、用焰色反应鉴别Na2CO3固体和NaHCO3固体 |
| C、用BaCl2溶液鉴别AgNO3溶液和Na2SO4溶液 |
| D、用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医疗上可用硫酸钡作x射线透视肠胃的内服药,是因为硫酸钡不溶于水 |
| B、酸雨指25℃时pH值小于7的降水 |
| C、加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水 |
| D、发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
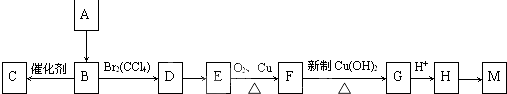
查看答案和解析>>
科目:高中化学 来源: 题型:
 具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如:具有三个官能团分别是(填名称):
具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如:具有三个官能团分别是(填名称):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com