
【题目】有机物种类繁多的主要原因是( )
A. 有机物的分子结构十分复杂
B. 碳原子能与其他原子形成四个共价键,而且碳原子之间也能互相成键
C. 有机物除含碳元素外,还含有其他多种元素
D. 自然界中存在多种形式的、大量的有机物
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】有机物键线式结构的特点是以线示键,每个折点和线端点处表示有一个碳原子,并以氢补足四价,C、H不标示出来。降冰片烷的立体结构可用键线式表示为
(1)其分子式为__________。
(2)当降冰片烷发生一氯取代时,能生成_________种沸点不同的产物。
(3)结合降冰片烷及其键线式,请你判断降冰片烷属于____________。
A.环烷烃 B.饱和烃 C.不饱和烃 D.芳香烃
(4)降冰片烷具有的性质是__________。
A.能溶于水 B.能发生加成反应
C.常温常压下为气体 D.能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律分析下面的推断正确的是( )
A. 铍(Be)是一种轻金属,它的氧化物的水化物可能具有两性
B. 砹单质是一种有色固体,砹化氢很不稳定,砹化银是难溶于水的白色沉淀
C. 硫酸锶难溶于水,但易溶于盐酸
D. 硒化氢是无色、有毒、比硫化氢稳定的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是三种元素的原子,质子数都小于18。A原子与B原子的最外层电子数都是6,A原子与C原子的核外电子层数都为3, C原子的质子数比A少4。回答下列问题:
(1)A、B、C的元素名称分别为________、________、________;
(2)A的离子结构示意图为________;
(3)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42-,1mol AB42-的质量为104g,则元素B的该核素中的中子数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
烧渣![]()
![]() 溶液
溶液![]() 绿矾
绿矾![]() 铁黄
铁黄
已知:FeS2和铁黄均难溶于水
下列说法不正确的是( )
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O===15Fe2++2SO![]() +16H+
+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁:另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的物质的量浓度为
A. ![]() molL﹣1 B.
molL﹣1 B. ![]() molL﹣1
molL﹣1
C. ![]() molL﹣1 D.
molL﹣1 D. ![]() molL﹣1
molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如右图所示(夹持仪器已略去)。
(1)实验前,应先检查装置的 ;实验中产生的尾气应通入 溶液进行处理。
(2)实验过程中需要配制100 mL l mo1·L-1 FeCl3溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、 ;实际配制过程中,常先将FeCl3固体完全溶于适量稀盐酸中,再加水稀释,此特殊操作的目的是____。
(3)该小组同学向5 mL l mo1·L-1 FeCl3溶液中通入足量的SO2,溶液最终呈浅绿色,写出其反应的离子方程式 。再打开分液漏斗活塞,逐滴加入煮沸冷却后的NaOH稀溶液,则试管B中产生的实验现象是 。
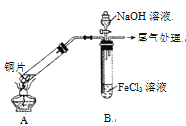
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔效应,最终溶液呈浅绿色。
【查阅资料】Fe(HSO3)2+在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO42-。则Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
(5)若实验中用5 mL一定浓度的浓H2SO4与适量Cu片充分反应,实验结束后,测得产生SO2的体积在标准状况下为672 mL,向已冷却的A试管溶液中加入4 mo1·L-1的NaOH溶液30 mL时,恰好使Cu2+完全沉淀。则所用浓H2SO4浓度为____。(忽略过程中溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(P),横轴表示固相中氢原子与金属原子的个数比(H/M)。

在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)==ZMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(I)中z=________ (用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=___________mL·g-lmin-1。反应的焓变△H1_____0(填“>”“<”或“=”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为Tl、T2时,η(T1)____η(T2)(填“>”“<”或“=”)。当反应(I )处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(I)可能处于图中的 ________点(填“b” “c”或“d”),该贮氢合金可通过________或____的方式释放氢气。
(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为___________。己知温度为 T 时:CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165kJ/mol CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41kJ/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com