
 如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是
如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是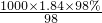 mol/L=18.4mol/L,
mol/L=18.4mol/L, ×100%=
×100%=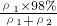 ×100%,因硫酸的密度大于水的密度,则ρ1>ρ2,所以
×100%,因硫酸的密度大于水的密度,则ρ1>ρ2,所以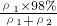 ×100%>49%,故B错误;
×100%>49%,故B错误;

科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
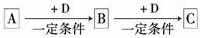 已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com