
【题目】A~J是中学化学常见的物质,它们之间的转化关系如下图所示 (部分反应条件、生成物已省略)。已知A是一种高熔点物质,D是一种红棕色固体。
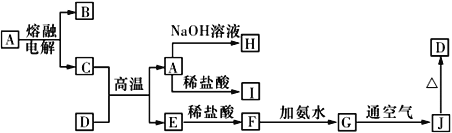
请回答下列问题:
(1)电解A物质的阴极电极反应式为________,C与D在高温下反应,引发该反应需要加入的两种试剂是________________________(填名称)。
(2)写出G→J反应的实验现象与化学方程式:____________________________,________________________________。
(3)C与NaOH溶液反应的离子方程式为________________________________。
【答案】 A13++3e-=Al 镁带、氯酸钾 白色沉淀迅速变为灰绿色,最终变为红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Al+2OH-+2H2O==2AlO2-+3H2↑
【解析】试题分析:由题意知,A是氧化铝、D是氧化铁,由图中转化关系,可以推断B是氧气、C是铝、E是铁、F是氯化亚铁、G是氢氧化亚铁、H是偏铝酸钠、I是氯化铝或氢气、J是氢氧化铁。
(1)电解A物质的阴极电极反应式为A13++3e-=Al,C与D在高温下反应,该反应为铝热反应,引发该反应需要加入的两种试剂是镁带、氯酸钾。
(2)G→J反应的实验现象为白色沉淀迅速变为灰绿色,最终变为红褐色;访反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)C与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O==2AlO2-+3H2↑。


科目:高中化学 来源: 题型:
【题目】某小组同学利用下图装置对电解氯化铜实验进行了研究。
装置 | 现象 |
| 电解一段时间时,阳极石墨表面产生气体,阴极石墨上附着红色物质,烧杯壁变热,溶液由蓝色变为绿色 |
(1)甲认为电解过程中阳极产生的_________是溶液变绿的原因。
(2)乙查阅资料,CuCl2溶液中存在平衡:Cu2+ + 4Cl-![]() [CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
[CuCl4]2-(黄色) ΔH>0。据此乙认为:电解过程中,[CuCl4]2-(黄色)浓度增大,与CuCl2蓝色溶液混合呈绿色。乙依据平衡移动原理推测在电解过程中[CuCl4]2-浓度增大的原因:________________。
(3)丙改用下图装置,在相同条件下电解CuCl2溶液,对溶液变色现象继续探究。
装置 | 现象 |
| 电解相同时间时,阳极石墨表面产生气泡,溶液仍为蓝色;阴极石墨上附着红色物质,溶液由蓝色变为绿色;U型管变热,冷却后阴极附近溶液仍为绿色 |
丙通过对现象分析证实了甲和乙的观点均不是溶液变绿的主要原因。丙否定甲的依据是________,否定乙的依据是________________。
(4)丙继续查阅资料:
i. 电解CuCl2溶液时可能产生[CuCl2]-,[CuCl2]-掺杂Cu2+后呈黄色
ii. 稀释含[CuCl2]-的溶液生成CuCl白色沉淀据此丙认为:电解过程中,产生[CuCl2]-掺杂Cu2+后呈黄色,与CuCl2蓝色溶液混合呈绿色。
丙进行如下实验:
a.取电解后绿色溶液2 mL,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
b. 另取少量氯化铜晶体和铜粉,向其中加2 mL浓盐酸,加热获得含[CuCl2]-的黄色溶液。
c. 冷却后向上述溶液……
d. 取c中2 mL溶液,加20 mL水稀释,静置5分钟后溶液中产生白色沉淀。
① a的目的是__________________。
② 写出b中生成[CuCl2]-的离子方程式:____________________。
③ 补充c中必要的操作及现象:____________________。
丙据此得出结论:电解时阴极附近生成[CuCl2]-是导致溶液变绿的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。电解一段时间后,若在电解池中C极一侧出来的气体无色无味,D极一侧出来的气体呈黄绿色有刺激性气味。请回答以下问题:
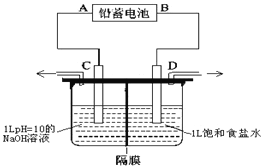
(1)已知铅蓄电池在放电时发生的反应:Pb+PbO2+4H++2SO42-=2PbSO4+2H2O,则A极为电源的_________极(填“正”或“负”),电极反应为___________________________;
(2)电解饱和食盐水的离子反应方程式是__________________;
(3)电极C的电极反应是_____________________________________________;
(4)电解时为防止两种气体产物混合,用阳离子交换膜做隔膜。则电解时Na+从______极区移向_____极区(填“C”或“D”);
(5)若电路上有0.2mol电子的电量通过,则铅蓄电池中消耗硫酸_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要内容,完成以下填空:
(1)标准状况下,①6.72 L NH3 ②1.204×1023个 H2S ③5.6 g CH4 ④0.5 mol HCl ,下列关系按由大到小排序
A.体积大小:___________________ B.质量大小:________________
C.密度大小:___________________D.原子数目:_________________
(2)标准状况下,33.6 L的HCl所具有的物质的量为_____________,将其溶解于水配成3 L的溶液,所得盐酸的物质的量浓度为__________。
(3)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________
(4)标准状况下,2.4 g某气体的体积为672 mL,则此气体的相对分子质量为_________
(5)0.5 L 1 mol/L CaCl2溶液中Ca2+的物质的量为_________,Cl的物质的量浓度为________
(6)0.3 mol NH3分子中所含原子数与___________个H2O分子中所含原子数相等
相同质量的SO2、SO3的物质的量之比为____________;氧原子的个数之比为___________
在0℃和101kPa的条件下,将2.00g氦气、1.40g氮气和1.60g氧气混合,该混合气体的体积是________L
若1gN2含a个原子,则阿伏加德罗常数可表示为_____________
由硫酸钾、硫酸铁和硫酸组成的混合溶液,其中c(H+)=0.1 mol/L,c(Fe3+)=0.3 mol/L,c(SO![]() )= 0.6 mol/L,则c(K+)为________
)= 0.6 mol/L,则c(K+)为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL浓度为2mol/L的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成的氢气的总量,可采用的方法是( )
A. 加入适量的6mol/L的硫酸 B. 适当加热
C. 加入适量蒸馏水 D. 加入适量的稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为不同化学元素组成的化合物示意图,以下说法正确的是( )
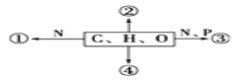
A. 若图中①为某种化合物的基本单位,则①最可能是核苷酸
B. 若②大量积累于皮下和内脏器官周围,则②是磷脂
C. 若④主要在人体肝脏和肌肉内合成,则④最可能是糖原
D. 若③为生物大分子,则一定被甲基绿染成绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)在一定条件下将CO2和H2转化为甲醇蒸气和水蒸气的相关反应有:
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H1=+41KJ/mol
CO(g)+H2O(g) △H1=+41KJ/mol
CO(g)+2 H2(g)![]() CH3OH(g) △H2=-90KJ/mol
CH3OH(g) △H2=-90KJ/mol
则由甲醇蒸气和水蒸气转化为CO2和H2的热化学方程式为___________________。
(2)在一定温度下,向2L固定容积的密闭容器中通入2molCO2、3molH2,发生反应
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H3<0.
CH3OH(g)+H2O(g) △H3<0.
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
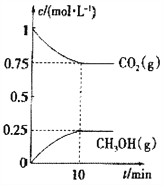
①能说明该反应已达平衡状态的是______________。
A.单位时间内有3nmolH—H键断裂,同时又有2nmolO—H键断裂
B.混合气体的平均相对分子质量不随时间变化
C.混合气体的密度不随时间变化
D.体系中n(CO2)/n(H2)=1∶1,且保持不变
②下列措施能使n(CH3OH)/n(CO2)增大的是__________。
A.升高温度B.恒温恒容下,再充入2molCO2、3molH2
C.使用高效催化剂 D.恒温恒容充入He(g)使体系压强增大
③已知该温度下此反应的平衡常数K=0.198,若使K的值变为1,应采取的措施是___________。
A.升高温度 B.降低温度 C.增大压强 D.恒压加入一定量H2
(3)捕捉CO2可以利用Na2CO3溶液。用100mL0.1 mol/LNa2CO3溶液完全捕捉0.44gCO2气体(溶液体积不变),所得溶液中c(HCO3-)+c(CO32-)+c(H2CO3)=__________mol/L
(4)用CO2和天然气可以制备CO和H2,CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4 的平衡转化率与温度及压强的关系如图所示,则压强P1 ____P2(填“>”或“<”)。若P2=3MPa,则T°C时该反应的平衡常数Kp =_____MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。密闭容器中浓度均为0.1mol/L的CH4与CO2,在一定条件下反应,测得CH4 的平衡转化率与温度及压强的关系如图所示,则压强P1 ____P2(填“>”或“<”)。若P2=3MPa,则T°C时该反应的平衡常数Kp =_____MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香蕉果实成熟过程中,果实中的贮藏物不断代谢转化,香蕉逐渐变甜。图A中 Ⅰ、Ⅱ 两条曲线分别表示香蕉果实成熟过程中两种物质含量的变化趋势。取成熟到第X天和第Y天的等量香蕉果肉,分别加等量的蒸馏水制成提取液。然后在a、b试管中各加5 mL第X天的提取液,在c、d试管中各加5 mL第Y天的提取液,如图B所示。
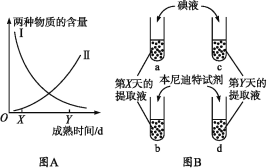
请回答下列问题。
(1)在a、c试管中各加入等量碘液后,a管呈蓝色,与a管相比c管的颜色更____,两管中被检测的物质是____,图A中表示这种物质含量变化趋势的曲线是____。
(2)在b、d试管中各加入等量的本尼迪特试剂,热水浴中加热2~3 min后,b管呈红黄色,与b管相比d管的颜色更____,两管中被检测的物质是____,图A中表示这种物质含量变化趋势的曲线是____。
(3)已知乙烯利能增加细胞内乙烯(能促进果实成熟)的含量。如果在第X天喷施乙烯利,从第X天开始曲线Ⅰ将呈现出____(“加快”或“减慢”)下降的趋势,曲线Ⅱ将呈现出____(“加快”或“减慢”)上升的趋势。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中加入0.100molNO和2.030mol固体活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如下表,下列说法正确的是
N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如下表,下列说法正确的是
温度 | C(s)/mol | NO/mol | N2/mol | CO2/mol |
200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 |
335℃ | 2.005 | 0.0500 | 0.0250 | 0.0250 |
A. 该反应的正反应为吸热反应
B. 反应体系在335℃时的平衡常数为0.25
C. 335℃与200℃时相比,活化分子个数、活化分子百分数、活化能及焓变均大
D. 200℃时,平衡后向恒容容器中再充入0.10molNO,再次平衡时,NO的百分含量将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com