

| ||


科目:高中化学 来源: 题型:
| A、若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 |
| B、若在阳极附近的溶液中滴入KI溶液,溶液呈棕色 |
| C、电解时在阳极得到氯气,在阴极得到金属钠 |
| D、电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| n(H2) |
| n(CO2) |
| n(H2) |
| n(CO2) |
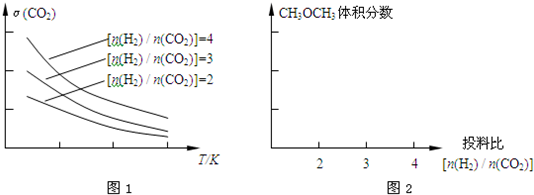
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
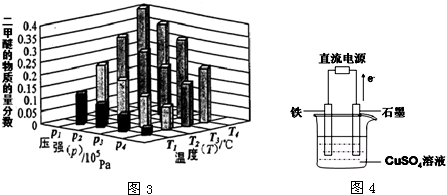
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | |
| 2 | C | D | |||||
| 3 | A | B | E | F |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、Ag+、Cl-、NO3- |
| B、K+、Na+、SO32-、S2- |
| C、K+、Na+、NO3-、SO42- |
| D、Ba2+、Fe2+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com