
分析 (1)氢氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
(2)新制氢氧化亚铁在空气被氧气氧化,白色的氢氧化亚铁被氧化成红褐色的氢氧化铁;
(3)二氧化硅与氢氟酸反应,生成四氟化硅气体和水;
(4)铵盐和碱反应生成氨气,实验室用固体氯化铵和固体氢氧化钙反应制备氨气;
(5)木炭与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水;
(6)铜和稀硝酸反应生成硝酸铜,一氧化氮和水.
解答 解:(1)氢氧化铝具有两性,与氢氧化钠溶液反应生成偏铝酸钠和水,该反应为Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(2)新制氢氧化亚铁在空气被氧化,氢氧化亚铁被氧化成氢氧化铁,反应的化学方程式是为:4Fe(OH)2+2H2O+O2═4Fe(OH)3,
故答案为:4Fe(OH)2+2H2O+O2═4Fe(OH)3;
(3)二氧化硅可以和唯一的酸HF之间反应生成四氟化硅和水,反应方程式为:SiO2+4HF=SiF4↑+2H2O,
故答案为:SiO2+4HF=SiF4↑+2H2O;
(4)固体氯化铵和固体氢氧化钙反应的方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(5)木炭与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水,反应的方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(6)铜具有还原性,稀硝酸具有氧化性,铜与稀硝酸发生氧化还原反应,生成硝酸铜,一氧化氮和水,反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O.
点评 本题考查了化学方程式的书写,侧重元素化合物知识的考查,把握反应物、生成物及化学反应遵循质量守恒定律为解答的关键,题目难度不大,注意掌握化学方程式的书写方法.


科目:高中化学 来源: 题型:选择题
| A. | 将Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,则样品已变质 | |
| B. | NaBr溶液中滴入少量氯水和CCl4,震荡,有机相呈橙色,则还原性:Br->Cl- | |
| C. | 某试液中滴入BaCl2溶液和稀硝酸有白色沉淀,则试液中一定含SO42-或SO32- | |
| D. | 溴乙烷与NaOH的乙醇溶液共热,逸出的蒸气直接通入酸性高锰酸钾溶液,溶液紫色褪去,则逸出的蒸气一定为纯净的乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入溴水;后加酸性高锰酸钾溶液 | |
| B. | 先加入银氨溶液;再另取该物质加入溴水 | |
| C. | 先加入酸性高锰酸钾溶液;后加银氨溶液,水浴加热 | |
| D. | 先加入新制氢氧化铜悬浊液,加热;酸化后再加入溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1 | B. | 0.02 mol•L-1 | C. | 1×10-7 mol•L-1 | D. | 1×10-12 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加碳酸钠(固体) | B. | 加水 | C. | 加金属钠 | D. | 加浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它的原子最外层有4个电子 | |
| B. | 它具有+2、+4价 | |
| C. | 金属铜能从114号元素的硝酸盐溶液中置换出该元素的单质 | |
| D. | 它的金属性比铅强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
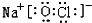 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二茂铁属于离子晶体 | |
| B. | 在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键 | |
| C. | 己知:环戊二烯的结构式为: ,则其中仅有1个碳原子采取sp3杂化 ,则其中仅有1个碳原子采取sp3杂化 | |
| D. | 二价铁离子的基态电子排布式为:[Ar]3d44s2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com