
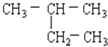

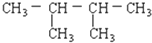
分析 同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
具有相同分子式而结构不同的化合物互为同分异构体;
同种元素形成的不同单质互为同素异形体;
质子数相同质量数(或中子数)不同的原子互称同位素;
组成和结构都相同的物质为同一物质,同一物质组成、结构、性质都相同,结构式的形状及物质的聚集状态可能不同.
解答 解:(1)液氯和(4)氯气都是氯气,是同一物质;
(2) 和(7)
和(7) 有机物结构简式的书写形状不同,具有相同的碳原子数,且结构相同,为同一种物质;
有机物结构简式的书写形状不同,具有相同的碳原子数,且结构相同,为同一种物质;
(5)2,2-二甲基丁烷和(8)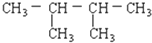 具有相同分子式而结构不同,互为同分异构体;
具有相同分子式而结构不同,互为同分异构体;
(3)白磷和(10)红磷是由磷元素组成的不同单质,互为同素异形体;
(9)${\;}_{17}^{35}$Cl和(11)${\;}_{17}^{37}$Cl质子数都为17,中子数不同,是氯元素的不同原子,互为同位素;
(2) 或(7)
或(7) 与(5)2,2-二甲基丁烷或(8)
与(5)2,2-二甲基丁烷或(8)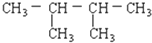 都是烷烃,结构相似,组成上相差1个CH2原子团,互为同系物;
都是烷烃,结构相似,组成上相差1个CH2原子团,互为同系物;
故答案为:(2)或(7)与(5)或(8);(5)和(8);(3)和(10);(9)和(11);(1)和(4)、(2)和(7).
点评 本题考查“五同”比较,题目难度不大,侧重考查学生的辨别能力,选项多,要细心排查.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
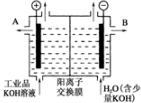
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁片换成铁粉 | B. | 把稀硫酸换成浓硫酸 | ||
| C. | 加热 | D. | 加入少量CuO粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④ | C. | ②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
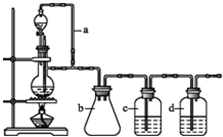 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
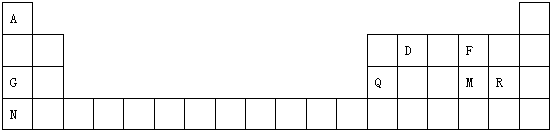
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
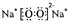 ,该物质含有的化学键的类型是离子键、非极性共价键 .
,该物质含有的化学键的类型是离子键、非极性共价键 . .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com