
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E,F和C位于同一主族,F处于第一个长周期.分析 原子序数依次增大的A、B、C、D、E、F六种元素,A的基态原子有3个不同能级,各能级中的电子数相等,则A是C元素;
C的基态原子2p能级上的未成对电子数与A原子的相同,C原子序数大于A,则C为O元素;
B原子序数大于A而小于C,则B是N元素;
E,F和C位于同一主族,F处于第一个长周期,则E为S元素、F为Se元素;
D为它所在周期中原子半径最大的主族元素,原子序数小于S,则D是Na元素;
(1)F是Cu元素,其原子核外有29个电子,根据构造原理书写F基态原子的核外电子排布式;
(2)由C、N、O形成的离子OCN-与CO2互为等电子体,等电子体结构相似;
(3)在元素C与S所形成的常见化合物CS2中,根据价层电子对理论确定A原子轨道的杂化类型;
(4)①A.N2O与CO2是等电子体,二者结构相似;
B.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
C.CH2=CHCHO分子中碳原子均形成3个σ键,没有孤对电子,杂化轨道数目为3;
D.含有氢键的氢化物熔点较高;
(5)根据均摊法可知,晶胞中P4分子数目为4,则晶胞中含有16个P原子,计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:原子序数依次增大的A、B、C、D、E、F六种元素,A的基态原于有3个不同的能级,各能级中的电子数相等,则A是C元素;C的基态原子2p能级上的未成对电子数与A原子的相同,C原子序数大于A,则C为O元素;
B原子序数大于A而小于C,则B是N元素;
E和C位于同一主族,且E原子序数小于25,则C是S元素;
D为它所在周期中原子半径最大的主族元素,原子序数小于S,则D是Na元素;
F的原子序数为29,为Cu元素;
(1)F是Cu元素,其原子核外有29个电子,根据构造原理知Cu元素基态原子的核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)由C、N、O形成的离子OCN-与CO2互为等电子体,根据二氧化碳结构式知OCN-的结构简式为[N=C=O]-;
故答案为:[N=C=O]-;
(3)在元素C与S所形成的常见化合物CS2中,二硫化碳分子中中心原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化;
故答案为:sp;
(4)①A.N2O与CO2是等电子体,二者结构相似,则N2O为直线型分子,故A正确;
B.同一周期元素的第一电离能随着原子序数的增大而呈增大趋势,由于氮原子2p轨道是半满稳定结构,第一电离能高于同周期相邻元素的,所以其第一电离能大小顺序是:N>O>C,故B错误;
C.CH2=CH-CHO分子中每个碳原子均形成三个σ键,没有孤对电子,杂化轨道数目为3,均采用sp2杂化,故C正确;
D.HCOOH分子间能形成氢键,CH3OCH3不能形成分子间氢键,所以相同压强下,HCOOH沸点比CH3OCH3高,故D错误.
故选:AC;
(5)根据均摊法可知,晶胞中P4分子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞中P原子数目为4×4=16,晶胞质量为16×$\frac{31}{N{\;}_{A}}$g,晶胞体积为(a cm)3,则晶胞密度为$\frac{\frac{16×31}{N{\;}_{A}}g}{(acm)^{3}}$=$\frac{496}{{a}^{3}N{\;}_{A}}$g•cm-3;
故答案为:16;$\frac{496}{{a}^{3}N{\;}_{A}}$.
点评 本题考查物质结构与性质,推断元素是解题关键,涉及核外电子排布、等电子体、电离能、杂化方式与空间构型判断、氢键、配合物、晶胞计算等,难度中等,注意理解同周期第一电离能异常情况,注意氢键对物质性质的影响.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 晶体硅硬度大、熔点高,因而可用于制作半导体材料 | |
| B. | 常温下铝制品可以储运浓硫酸和浓硝酸 | |
| C. | 水煤气、液氯、水玻璃、福尔马林为混合物 | |
| D. | 金属汞一旦洒落在实验室地面或桌面上,必须尽快收集,并深埋处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
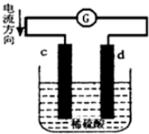 将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )
将铜片、锌片插入500mL2mol/L稀硫酸中组成原电池,c、d为两个电极.则下列有关的判断正确的是(溶液体积变化忽略不计)( )| A. | c为负极,其质量逐渐减小,发生还原反应 | |
| B. | 当有0.2mol电子通过电路,正极表明产生气体2.24L | |
| C. | 电池工作的过程中,溶液中SO42-浓度逐渐减小 | |
| D. | 当负极质量减轻32.5g时,烧杯中溶液中H+的浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度不随时间变化 | |
| C. | 容器内X、Y、Z浓度之比为1:2:2 | |
| D. | 混合气的平均摩尔质量不随时间变化时 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 奥运火炬燃烧主要是将化学能转变为热能和光能 | |
| B. | 丙烷常温下是液体 | |
| C. | 丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极 | |
| D. | 丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | 浓度mol•L-1 | 离子 | 浓度mol•L-1 |
| Na+ | 0.1 | Cl- | 0.9 |
| Ag+ | 0.5 | NO3- | 0.3 |
| Mg2+ | 0.3 |
| 离子 | 浓度mol•L-1 | 离子 | 浓度mol•L-1 |
| Na+ | 0.1 | Cu2+ | 0.2 |
| Ba2+ | 0.5 | NO3- | 1.5 |
| Mg2+ | 0.3 | Cl- | 0.6 |
| 离子 | 浓度mol•L-1 | 离子 | 浓度mol•L-1 |
| Na+ | 0.1 | Cl- | 0.2 |
| K+ | 0.5 | NO3- | 0.3 |
| Mg2+ | 0.3 | SO42- | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请完成并配平上列的离子方程式.
请完成并配平上列的离子方程式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com