
 (填结构简式)
(填结构简式) 分析 某烷烃的蒸气质量是氢气质量的36倍,则其相对分子质量为36×2=72,结合烷烃的组成通式确定分子式,书写可能的结构简式;戊烷的同分异构体中,支链越多沸点越低;正戊烷分子中含有1种H,其一氯代物只有一种,据此进行解答.
解答 解:某烷烃蒸气的质量是相同状况下同体积氢气质量的36倍,则其相对分子质量为:36×2=72,烷烃的组成通式为CnH2n+2,则:14n+2=72,解得:n=5,故该烷烃的分子式为:C5H12;
戊烷分子中,所有的碳原子在一条链上:CH3-CH2-CH2-CH2-CH3,拿下1个碳原子作为支链: ,拿下2个碳原子作为支链:
,拿下2个碳原子作为支链: ,所以戊烷存在3种同分异构体;
,所以戊烷存在3种同分异构体;
戊烷分子中,支链越多沸点越低,则沸点最高的为正戊烷:CH3-CH2-CH2-CH2-CH3;
其中一种结构它的一氯代物只有一种结构,即只有一种氢原子的为正戊烷,其结构简式为: ,
,
故答案为:C5H12;3;CH3-CH2-CH2-CH2-CH3; .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度不大,明确同分异构体的书写原则为解答关键,只有掌握常见有机物组成、结构及性质,是培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:推断题
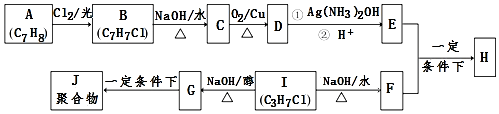
 .
. .
.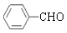 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$ +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时A的总转化率为40% | B. | 达到平衡时c(B)为1.0mol•L-1 | ||
| C. | 达到平衡时c(B)=2c(D) | D. | 达到平衡时c(D)为0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据Ksp(AgCl)>Ksp( AgBr),可知AgCl的溶解能力比AgBr强 | |
| B. | 加入足量浓AgNO3溶液后,AgCl和AgBr的溶度积Ksp均不变 | |
| C. | 加入足量浓AgNO3溶液后,溶液中只有AgBr沉淀 | |
| D. | 在含有AgBr、AgCl固体的悬浊液中,c (Cl-)>c (Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
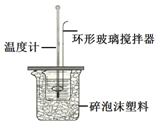 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| HCl | NaOH | ||
| 1 | 26.1 | 26.1 | 29.3 |
| 2 | 25.9 | 25.9 | 29.0 |
| 3 | 26.3 | 26.3 | 29.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(B)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 前50s内B的平均反应速率v(B)=0.0032mol•L-1•s-1 | |
| B. | 相同温度下,若达平衡后向容器中继续充入A,则平衡向右移动,平衡常数增大 | |
| C. | 相同温度下,若起始时向容器中充入1.0mol A、0.20mol B和0.20mol C,则达到平衡前 v(正)>V(逆) | |
| D. | 若保持其他条件不变,升高温度,平衡时,平衡常数K=0.2mol.L-1,则反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2的燃烧热为285.8 kJ•mol-1,则表示H2燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 中和热为57.3 kJ•mol-1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知:C(s,金刚石)+O2(g)═CO2(g)△H=-395.4 kJ•mol-1,C(s,石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1,则C(s,金刚石)═C(s,石墨)△H=-1.9 kJ•mol-1 | |
| D. | 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,46 gNO2与N2O4的混合气体中含有的分子总数为NA | |
| B. | 常温常压下,将0.1molFe投人足量的浓硝酸中,转移的电子数为0.3NA | |
| C. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| D. | 0.1mol乙烯和乙醇的混合物完全燃烧所消耗O2的分子数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com