
【题目】下列说法不正确的是
A. 增大压强,活化分子百分数不变,化学反应速率增大
B. 升高温度,活化分子百分数增大,化学反应速率增大
C. 增大反应物浓度,活化分子百分数增大,化学反应速率增大
D. 使用催化剂,活化分子百分数增大,化学反应速率增大
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是
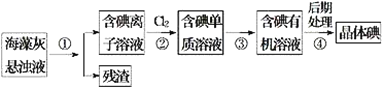
A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A. 酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B. 滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C. 酸式滴定管在滴定前有气泡,滴定后气泡消失
D. 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界存在丰富的碳、氮、硅、磷、铁、铜等元素,它们可形成单质及许多化合物。回答下列问题:
(1)C、N、Si原子的第一电离能由大到小的顺序是____________________。
(2)亚磷酸(H3PO3)与过量NaOH反应生成亚磷酸氢二钠(Na2HPO3),则亚磷酸的结构式为________________________。
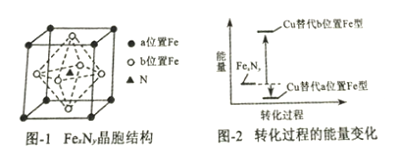
(3)某FexNy的晶胞结构如图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图-2所示,其中更稳定的Cu替代型产物的化学式为___________________。
(4)乙酰基二茂铁是常用汽油抗震剂,其结构如图3所示,该物质中碳原子的杂化方式有___________,亚铁离子具有强还原性,从电子排布的角度解释其原因_______________。

(5)金刚石晶胞结构如图-4,立方BN结构与金刚石相似、硬度与金刚石相当。在立方BN晶体中,B原子与N原子之间共价键与配位键数目比为____________;每个N原子周围最近且等距离的N原子数为_______________;如果阿伏加德罗常数近似取6×1023mol-1,立方BN的密度为ag·cm-3,摩尔质量为bg·mol-1,计算晶体中最近的两个N原子间距离是_________nm(用含a、b代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,不正确的是( )
A.SO2可用于漂白纸浆
B.SiO2是良好的半导体材料
C.Na2O2可用作潜水艇O2来源
D.Cl2可用于消毒和制造漂白粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH=1的硝酸溶液,有关叙述:
①该溶液1mL稀释至100mL后,pH=3
②向该溶液中加入等体积、pH=13的氢氧化钡溶液恰好完全中和
③该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为1×10﹣12
④向该溶液中加入等体积、等浓度的氨水,所得溶液pH=7
其中正确的是
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇(CH3OH)是重要的溶剂和替代燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。
CH3OH(g),在体积为1L的恒容密闭容器中,充入2molCO和4molH2,一定条件下发生上述反应,测得CO(g)和CH3OH(g)的浓度随时间变化如图一所示。

①从反应开始到5min,用CO表示的平均反应速率v(CO)=________。
②下列说法正确的是____________(填字母序号)。
A.达到平衡时,H2的转化率为65%
B.5min后容器中混合气体的平均相对分子质量不再改变
C.达到平衡后,再充入氩气,反应速率减小
D.2min前v(正)>v(逆),2min后v(正)<v(逆)
(2)碳与水蒸气反应制取H2的相关反应如下:
Ⅰ:C(s)+H2O(g)=CO(g)+H2(g) △H=+131.0kJ/mol
Ⅱ:CO(g)+H2O(g)=CO2(g)+H2(g) △H= - 43kJ/mol
Ⅲ:CaO(s)+CO2(g)=CaCO3(S) △H= - 178.3kJ/mol
①计算反应ⅣC(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g)的△H=_______kJ/mol;
CaCO3(s)+2H2(g)的△H=_______kJ/mol;
若K1、K2、K3分别为反应Ⅰ、Ⅱ、Ⅲ的平衡常数,则反应Ⅳ平衡常数K=__________(用K1、K2、K3表示)。
②对于可逆反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
CaCO3(s)+2H2(g),采取以下措施可以提高H2产率的是________。(填字母)
A.降低体系的温度 B.压缩容器的体积 C.增加CaO的量 D.选用适当的催化剂
(3)对于可逆反应C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g),该反应_______(填“能”或“不能”)自发进行。
CaCO3(s)+2H2(g),该反应_______(填“能”或“不能”)自发进行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com