
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g) CO(g)+ 3H2(g)。
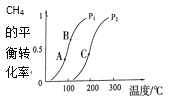
(1)一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl __P2(填“<”、“>”“=”);A、B、C三点处对应平衡常数(KA、KB、KC)由大到小的顺序为___。
(2)100℃时,将1 mol CH4和2 mol H2O通入容积固定为10 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则H2的反应速率v(H2)=____。100℃时该反应的平衡常数K =____。反应达到平衡的标志是:____。
A.容器内气体密度恒定 B.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
C.容器的压强恒定 D.3v正(CH4)= v逆(H2)
(3)为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有____(填编号)。
A.升高温度 B.缩小容器体积
C.再充入CH4气体 D.使用合适的催化剂
【答案】< KC>KB>KA 0.03 mol·L-1·min-1 0.0225 CD B
【解析】
(1)温度不变,随着压强增大,平衡逆向移动,甲烷的平衡转化率减小,所以Pl <P2,随着温度升高,平衡转化率增大,说明平衡常数变大,即KC>KB>KA;
(2)甲烷的消耗量为0.5mol,则根据方程式分析,生成1.5mol氢气,则用氢气表示的反应速率为 ;
;
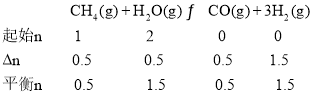
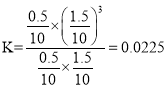 ;
;
A. 根据质量守恒定律,反应前后气体的质量不变,在恒容体系中气体体积不变,所以密度不变,A错误;
B. 单位时间内消耗0.1 mol CH4同时生成0.3 molH2均表示正反应速率,B错误;
C. 容器的压强恒定可以说明体系内各组分的含量不再改变,C正确;
D. 3v正(CH4)= v逆(H2),则说明正逆反应速率相等,D正确;
故答案选CD;
(3)A. 升高温度平衡正向移动,体系中气体物质的量增加,A错误;
B. 缩小容器体积,反应速率加快,平衡逆向移动,气体物质的量减小,B正确;
C. 再充入CH4气体,反应速率增加,平衡正向移动,气体物质的量增加,C错误;
D. 加入催化剂,反应速率加快,平衡不移动,D错误;
故答案选B。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】在容积为672 mL的烧瓶中充满NO和NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且液体充满烧瓶(气体体积都已折合为标准状况下的体积),下列有关叙述正确的是( )
A. 总反应为NO+NO2+O2+H2O===2HNO3
B. 总反应为4NO+8NO2+5O2+6H2O===12HNO3
C. 生成硝酸的物质的量浓度均为0.030 mol·L-1
D. 生成硝酸的物质的量浓度约为0.060 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
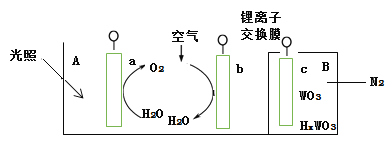
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
3C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
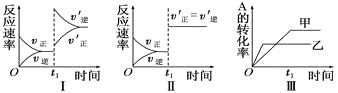
A. 图Ⅰ表示的是t1时刻增大反应物的浓度对反应速率的影响
B. 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是温度对化学平衡的影响,且乙的温度较高
D. 图Ⅲ表示的是不同催化剂对平衡的影响,且甲的催化效率比乙高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O==Zn(OH)2+2Ag,其工作示意图如图。下列说法不正确的是:

A. Ag2O电极是正极
B. 电子由Zn电极流出,经过KOH溶液流入Ag2O电极
C. Zn电极的电极反应式:Zn-2e-+2OH-==Zn(OH)2
D. 溶液中OH-向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是

A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是

A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锂广泛应用于陶瓷和医药等领域,在水中的溶解度比较小。以锂辉石(主要成分为Li2O,含有少量SiO2、Al2O3、Fe2O3)为原料制备Li2CO3的流程如图:
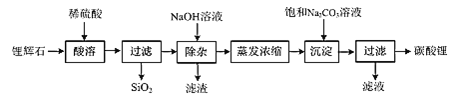
⑴写出“酸溶”时Li2O发生反应的离子方程式:______。
⑵“除杂”时所用NaOH溶液不能过量,原因是______。
⑶“除杂”时检验铁元素已完全除去的方法是______。
⑷写出“沉淀”时反应的化学方程式:______。
⑸检验最终所得碳酸锂样品中是否含有Na2CO3的方法是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种中学常见物质均含有同一种元素,且A为单质,有如图2所示的转化关系。则下列分析中不正确的是

A.若ABCDE中同一种元素的价态均不相同,则A为非金属单质
B.若A为金属钠,则由1mol D完全反应生成C时,一定有1mol电子转移
C.若A为非金属硫,则④的反应类型既可能为氧化还原反应,也可能为非氧化还原反应
D.若A为金属铁,则化合物C和D均可以由化合反应制得
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com