
【题目】银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O==Zn(OH)2+2Ag,其工作示意图如图。下列说法不正确的是:

A. Ag2O电极是正极
B. 电子由Zn电极流出,经过KOH溶液流入Ag2O电极
C. Zn电极的电极反应式:Zn-2e-+2OH-==Zn(OH)2
D. 溶液中OH-向负极移动
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被誉为“21世纪的金属”,可呈现多种化合价。其中以+4价的Ti最为稳定。
(1)基态Ti原子的价电子轨道表示式为_______________。
(2)已知电离能:I2(Ti)=1310kJ/mol,I2(K)=3051kJ/mol。I2(Ti)<I2(K),其原因为________。
(3)钛某配合物可用于催化环烯烃聚合,其结如图所示:
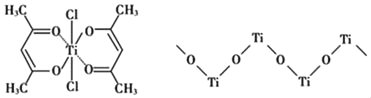
①钛的配位数为_____,碳原子的杂化类型_____。
②该配合物中存在的化学键有___________(填字母标号)。
a.离子健 b.配位键 c.金属健 d.共价键 e.氢键
(4)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如上图所示,该阳离子化学式为________,阴离子SO42—的空间构型为____。
(5)钛与卤素形成的化合物熔沸点如下表所示:
TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | ﹣24.1 | 38.3 | 155 |
沸点/℃ | 136.5 | 233.5 | 377 |
分析 TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是:_____。
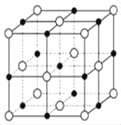
(6)已知TiN晶体的晶胞结构如下图所示,若该晶胞的密度ρg/cm3,阿伏加德罗常数值为NA,则晶胞中Ti原子与N原子的最近距离为________pm.(用含ρ、NA的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化二氯(Cl2O)是一种常用的氯化剂。常温下,Cl2O是棕黄色、有刺激性气味的气体,熔 点为-120.6°C,沸点为2.0°C,易与水反应生成次氯酸。实验室欲用氯气通入含水8%的碳酸钠固体中 制备并收集少量纯净的Cl2O,请用下列装置设计实验并探究相关物质的性质。
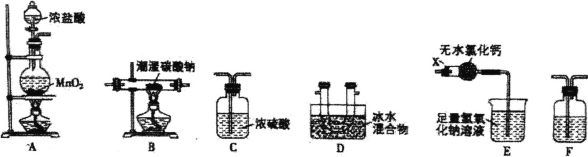
(1)装置E中仪器X的名称为 ______。
(2)装置的连接顺序是A __________(每个装置限用一次)。
(3)装置F中盛装试剂的名称为______,装置E中无水氯化钙的作用是 ________.。
(4)装置B残留固体中除NaCl外还含有一种酸式盐M,写出装置B中发生反应的化学方程式 _______。
(5)证明残留固体中含有M的最简单的实验方案是: _______。
(6)测定残留固体中M的质量分数:取mg样品加适量蒸馏水使之溶解,加入几滴酚酞,用0.1 mol/L 的盐酸标准溶液滴定至溶液由红色变为无色,消耗盐酸V1mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸V2 mL.。
①实验时用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、____。
②求残留固体中M的质量分数__________(用含m、V1和![]() 的代数式表示)。
的代数式表示)。
③若用甲基橙作指示剂滴定结束时,滴定管尖头有气泡,测定结果将____填“偏高"、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g) CO(g)+ 3H2(g)。
(1)一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl __P2(填“<”、“>”“=”);A、B、C三点处对应平衡常数(KA、KB、KC)由大到小的顺序为___。
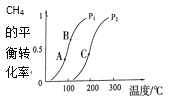
(2)100℃时,将1 mol CH4和2 mol H2O通入容积固定为10 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则H2的反应速率v(H2)=____。100℃时该反应的平衡常数K =____。反应达到平衡的标志是:____。
A.容器内气体密度恒定 B.单位时间内消耗0.1 mol CH4同时生成0.3 molH2
C.容器的压强恒定 D.3v正(CH4)= v逆(H2)
(3)为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有____(填编号)。
A.升高温度 B.缩小容器体积
C.再充入CH4气体 D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于合成氨工业:N2(g)+3H2(g)![]() 2NH3(g)+QkJ(Q>0),下列说法正确的是( )
2NH3(g)+QkJ(Q>0),下列说法正确的是( )
A.1molN2和3molH2的总键能大于2molNH3的总键能
B.使用铁触媒作为催化剂对Q值的大小无影响
C.用水吸收NH3后,剩余N2和H2循环利用提高原料利用率
D.反应采用高温条件,可以用勒夏特列原理解释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
(1)1 m3(标准状况)CH4按上式完全反应,产生H2_________mol。(精确到0.1)
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。1 m3(标准状况)CH4按上述两式完全反应,产物气体的体积V m3(标准状况)的取值范围为________。
(3)CH4和H2O(g)及富氧空气(O2含量较高的空气)混合反应,产物气体组成如下表:
气体 | CO | H2 | N2 | O2 |
体积(L) | 25 | 60 | 15 | 2.5 |
计算该富氧空气中O2和N2的体积比,V(O2):V(N2)=________。
(4)若CH4和H2O(g)及(3)题中的富氧空气混合反应,产物气体中V(H2):V(N2)=3:1(合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com