
【题目】关于合成氨工业:N2(g)+3H2(g)![]() 2NH3(g)+QkJ(Q>0),下列说法正确的是( )
2NH3(g)+QkJ(Q>0),下列说法正确的是( )
A.1molN2和3molH2的总键能大于2molNH3的总键能
B.使用铁触媒作为催化剂对Q值的大小无影响
C.用水吸收NH3后,剩余N2和H2循环利用提高原料利用率
D.反应采用高温条件,可以用勒夏特列原理解释
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为 。

②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种物质有如图所示转化关系,其中X与稀盐酸不反应:
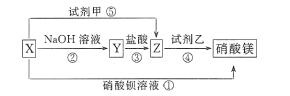
(1)根据上述转化关系,推断下列物质的化学式: X_____,Y_____,Z____,试剂甲____,试剂乙____。
(2)写出上述①~⑤步反应的离子方程式:
①____________________________________________。
②____________________________________________。
③____________________________________________。
④____________________________________________。
⑤____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O==Zn(OH)2+2Ag,其工作示意图如图。下列说法不正确的是:

A. Ag2O电极是正极
B. 电子由Zn电极流出,经过KOH溶液流入Ag2O电极
C. Zn电极的电极反应式:Zn-2e-+2OH-==Zn(OH)2
D. 溶液中OH-向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据原电池原理,回答下列问题:
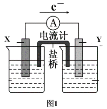
(1)图1是依据氧化还原反应:Zn +Cu 2+=Zn 2++Cu 设计的原电池装置。
①电极X的材料是_____(填化学名称),反应过程中电极X的现象是_______。
②Y电极发生的电极反应式为:_______。
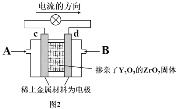
(2)图2是使用固体电解质的燃料电池,该燃料电池总反应方程式为:CH4+2O2 =CO2+2H2O。装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子(O2+4e― = 2O2-)。
①c电极为____极。(填“正”或“负”)
②B物质为______。
③d电极上的电极反应式为_______。
④固体电解质中O2-离子移向_______电极。(填“c”或“d”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是

A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
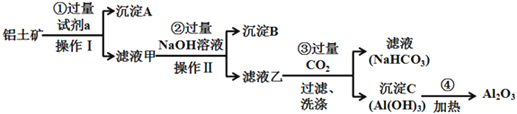
(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH-=H2O还有:
_____________________________、________________________________;
(3)步骤③中通入过量CO2气体的离子方程式有______________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
容器(温度) | t(min) c(molL-1) | 0 | 40 | 80 | 120 | 160 |
甲(400℃) | c(NO) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(400℃) | c(NO) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙(T℃) | c(NO) | 2.00 | 1.40 | 1.10 | 1.10 | 1.10 |
A.达到平衡状态时,2v正c(NO)=v逆c(N2)
B.容器内压强不再改变说明反应已达平衡
C.丙容器中从反应开始到建立平衡的平均反应速率v c(NO)=0.01125 mol·L-1·min-1
D.由表格数据可知:T>400
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO42-、Cl-中的若干种,现取X溶液进行实验,实验过程及产物如图。下列说法正确的是( )
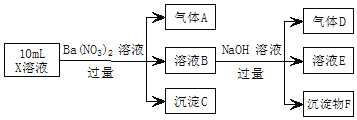
A.A是一种无色、无毒的气体
B.沉淀F为![]()
C.实验室可用排水法收集气体D
D.往溶液E中通入少量![]() ,有沉淀产生
,有沉淀产生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com