
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO42-、Cl-中的若干种,现取X溶液进行实验,实验过程及产物如图。下列说法正确的是( )
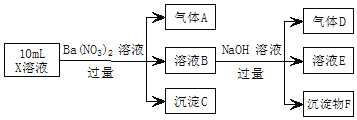
A.A是一种无色、无毒的气体
B.沉淀F为![]()
C.实验室可用排水法收集气体D
D.往溶液E中通入少量![]() ,有沉淀产生
,有沉淀产生
【答案】D
【解析】
强酸性溶液含大量的氢离子,一定不会存在CO32-,结合实验流程可知,加入过量硝酸钡生成沉淀,则该沉淀C为BaSO4,说明溶液中含有SO42-离子,生成气体A,因酸性条件下硝酸根离子具有强氧化性,可以和还原性的离子发生反应生成NO气体,所以溶液一定含Fe2+离子;溶液B中加入过量NaOH溶液,生成气体D,则D为NH3,说明溶液中含有NH4+离子,沉淀物F为Fe(OH)3,溶液E中含NaOH、硝酸钡,且E中可能含偏铝酸钠,据此分析解答。
由上述分析可知,X中一定含Fe2+、NH4+、SO42-,可能含A13+、C1-,一定不含CO32-。
A.A为NO,为无色有毒气体,故A错误;
B.由3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,B中含氧化还原反应生成的铁离子,与NaOH反应生成F为Fe(OH)3,故B错误;
C.D为氨气,极易溶于水,不能用排水法收集,故C错误;
D.E中含NaOH、硝酸钡,可能含偏铝酸钠,通入二氧化碳一定发生CO2+2OH-+Ba2+=BaCO3↓+H2O,可能发生2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,则往溶液E中通入少量CO2,有沉淀产生,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】关于合成氨工业:N2(g)+3H2(g)![]() 2NH3(g)+QkJ(Q>0),下列说法正确的是( )
2NH3(g)+QkJ(Q>0),下列说法正确的是( )
A.1molN2和3molH2的总键能大于2molNH3的总键能
B.使用铁触媒作为催化剂对Q值的大小无影响
C.用水吸收NH3后,剩余N2和H2循环利用提高原料利用率
D.反应采用高温条件,可以用勒夏特列原理解释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g) ΔH<0,下列说法正确的是
2AB2(g) ΔH<0,下列说法正确的是
A. 达平衡后降低温度,混合气体平均相对分子质量减小
B. 使用催化剂能加快反应速率,缩短达平衡所需的时间且提高A2的转化率
C. 达平衡后升高温度并增大压强,有可能每一组分的百分含量都不改变,但平衡常数一定发生改变
D. 达平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
(1)1 m3(标准状况)CH4按上式完全反应,产生H2_________mol。(精确到0.1)
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。1 m3(标准状况)CH4按上述两式完全反应,产物气体的体积V m3(标准状况)的取值范围为________。
(3)CH4和H2O(g)及富氧空气(O2含量较高的空气)混合反应,产物气体组成如下表:
气体 | CO | H2 | N2 | O2 |
体积(L) | 25 | 60 | 15 | 2.5 |
计算该富氧空气中O2和N2的体积比,V(O2):V(N2)=________。
(4)若CH4和H2O(g)及(3)题中的富氧空气混合反应,产物气体中V(H2):V(N2)=3:1(合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
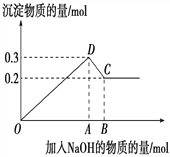
(1)写出代表下列线段发生的反应的离子方程式:
DC段________________________________________________。
(2)原溶液中Mg2+、Al3+的物质的量之比为_____________。
(3)图中B点时所加入溶液中含NaOH为________mol
(4)若向50 mL 2 mol·L-1的AlCl3溶液中加入100 mL KOH溶液,充分反应后得到3.12g沉淀。则KOH的物质的量浓度可能为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质 A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。 下列推断不正确的是 ( )

A. 若D为NaCl,且A可与C反应生成B,则 E 可能是 CO2
B. 若D是一种强碱, 则A、B、C 均可与 X 反应生成 D
C. 若D是一种白色沉淀, 在空气中最终变为红褐色,则 A可能是铁
D. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。请回答下列问题:
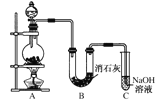
(1)A为实验室制氯气的发生装置,反应化学方程式为_________________________;某学生用12 mol·L-1的浓盐酸100 mL和足量的MnO2反应制Cl2,实际得到的Cl2________6.72 L(填“<”、“>”或“=”)。
(2)漂白粉将在U形管中产生,其化学方程式是_________________________________。
(3)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是________________。
②Cl2中含HCl,会发生反应2HCl+Ca(OH)2===CaCl2+2H2O,为避免此副反应的发生,可将装置作何改进______________________________。
(4) C装置的作用是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为探究AgNO3溶液和不同类型盐溶液反应的多样性,设计如图实验:已知:AgSCN为白色难溶物。下列说法不正确的是( )

A.①中的白色沉淀是![]()
B.向①的试管中滴加![]() KI溶液,有黄色沉淀生成证明存在
KI溶液,有黄色沉淀生成证明存在![]()
![]()
![]()
C.②中发生了氧化还原反应
D.对于②中红色褪去的原因可能与平衡移动原理有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是
4NO+6H2O,对于该反应判断正确的是
A. 氧气被还原B. 该反应是置换反应
C. 氨气是氧化剂D. 若有17 g氨参加反应,反应中转移10 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com