
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g) ΔH<0,下列说法正确的是
2AB2(g) ΔH<0,下列说法正确的是
A. 达平衡后降低温度,混合气体平均相对分子质量减小
B. 使用催化剂能加快反应速率,缩短达平衡所需的时间且提高A2的转化率
C. 达平衡后升高温度并增大压强,有可能每一组分的百分含量都不改变,但平衡常数一定发生改变
D. 达平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z三种物质有如图所示转化关系,其中X与稀盐酸不反应:
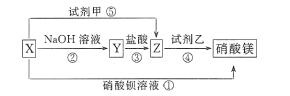
(1)根据上述转化关系,推断下列物质的化学式: X_____,Y_____,Z____,试剂甲____,试剂乙____。
(2)写出上述①~⑤步反应的离子方程式:
①____________________________________________。
②____________________________________________。
③____________________________________________。
④____________________________________________。
⑤____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
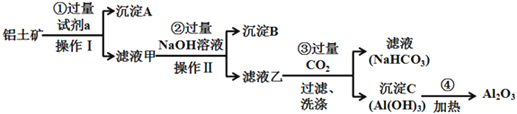
(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH-=H2O还有:
_____________________________、________________________________;
(3)步骤③中通入过量CO2气体的离子方程式有______________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
容器(温度) | t(min) c(molL-1) | 0 | 40 | 80 | 120 | 160 |
甲(400℃) | c(NO) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(400℃) | c(NO) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙(T℃) | c(NO) | 2.00 | 1.40 | 1.10 | 1.10 | 1.10 |
A.达到平衡状态时,2v正c(NO)=v逆c(N2)
B.容器内压强不再改变说明反应已达平衡
C.丙容器中从反应开始到建立平衡的平均反应速率v c(NO)=0.01125 mol·L-1·min-1
D.由表格数据可知:T>400
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理在科研和生产中有广泛应用。
(1)难挥发性TaS2可采用如下装置提纯:将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中,反应如下:TaS2(s)+2I2(g)![]() TaI4(g)+S2(g),△H>0,下列说法正确的是:_____
TaI4(g)+S2(g),△H>0,下列说法正确的是:_____

A 在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
B 改变压强,平衡不发生移动,所以反应放出的热量不变
C 加入催化剂,改变了反应的途径,反应的△H也随之改变
D 向容器中加入更多的TaS2(s)可以提高I2(g)的转化率
(2)在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中曲线所示。
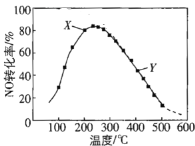
①下列说法不正确的是_____________。
A 反应2NO(g)+O2(g)![]() 2NO2(g),温度升高NO转化率增大说明正反应为吸热反应
2NO2(g),温度升高NO转化率增大说明正反应为吸热反应
B 图中X点所示条件下,延长反应时间能提高NO转化率
C 图中Y点所示条件下,增加O2的浓度能提高NO转化率
D 3800C下,C起始(O2)=5.0×10-4 mol·L-1,NO平衡转化率为50%,则平衡常数K<2000
②请在上图中画出不同温度下NO转化为NO2的平衡曲线_____。
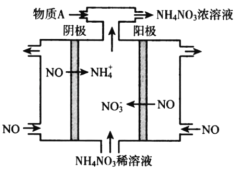
(3)电解NO可制备NH4NO3,其工作原理如下图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_________,写出电解过程的总反应化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
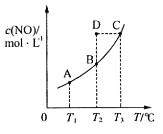
A. 该反应的△H>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.在T2时,若反应体系处于状态D,则此时![]()
D.若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应为Nz(g)+3H2(g) ![]() 2NH3(g),对其研究如下:在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1L 的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表;
2NH3(g),对其研究如下:在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1L 的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1) 前10min 中利用N2表示的反应速率为________
(2) 该温度下,此反应的平衡常数K=__________
(3) 该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正_______v逆(填“>”、“<”或“=”)。
(4) 该温度下,在上述平衡体系中再通入2molNH3,一段时间后,达到新的平衡。此时c(H2)____ 4.5mo1/L(填“>”、“<”或“=”)。
(5) 由上表中的实验数据计算得到“浓度-时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______。在此温度下,若起始充入4 mol Nz 和12 mol Hz,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_______。
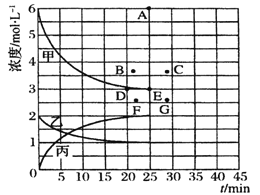
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO42-、Cl-中的若干种,现取X溶液进行实验,实验过程及产物如图。下列说法正确的是( )
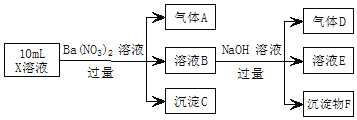
A.A是一种无色、无毒的气体
B.沉淀F为![]()
C.实验室可用排水法收集气体D
D.往溶液E中通入少量![]() ,有沉淀产生
,有沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属加工厂排放的污水中含有CuSO4、ZnSO4、FeSO4,某研究小组利用该污水回收工业重要原料硫酸锌和有关金属,其流程如下:
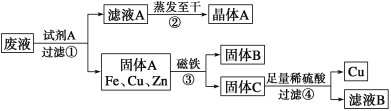
请回答下列问题:
(1)下列说法正确的是________。
A.该工艺流程中发生了3个置换反应
B.CuSO4与Mg(OH)2发生复分解反应可得Cu(OH)2
C.步骤①②③④都包含化学变化
(2)写出步骤①发生反应的离子方程式:__________________、_________________
(3)步骤④中加入足量稀硫酸的目的是________________
(4)滤液B含有的分散质为____________、___________ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com