
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
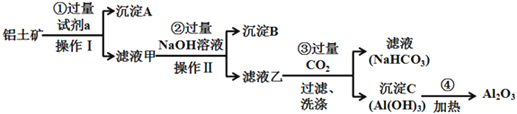
(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH-=H2O还有:
_____________________________、________________________________;
(3)步骤③中通入过量CO2气体的离子方程式有______________________;
【答案】SiO2 Fe3++3OH-=Fe(OH)3↓ Al3++4OH-=AlO2-+2H2O CO2+OH- = HCO3-;AlO2-+ CO2+2H2O = HCO3- +Al(OH)3 ↓
【解析】
根据工艺流程得出试剂a为盐酸,氧化铝、氧化铁与盐酸反应生成氯化铝和氯化铁,而二氧化硅和盐酸不反应,沉淀A为二氧化硅,滤液中有氯化铝、氯化铁、过量盐酸,再加氢氧化钠溶液,得到氢氧化铁沉淀和偏铝酸钠溶液,过滤,沉淀B为氢氧化铁,滤液为偏铝酸钠与二氧化碳反应生成氢氧化铝和碳酸氢钠溶液,氢氧化铝加热变为氧化铝。
(1)二氧化硅不与盐酸反应,因此沉淀A的成分是(填化学式) SiO2,故答案为:SiO2。
(2)步骤②滤液主要是氯化铝、氯化铁、过量盐酸,加入过量NaOH溶液,先发生酸碱中和反应,再与铁离子和铝离子反应,发生反应的离子方程式,除了H++OH- = H2O还有:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O;故答案为:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O。
(3)步骤③中通入过量CO2气体,先氢氧化钠和二氧化碳反应,再是偏铝酸钠和二氧化碳反应生成碳酸氢钠和氢氧化铝,其离子方程式有CO2+OH- = HCO3-;AlO2-+ CO2+2H2O = HCO3- +Al(OH)3 ↓,故答案为:CO2+OH- = HCO3-;AlO2-+ CO2+2H2O = HCO3- +Al(OH)3 ↓。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(图2),若原料完全反应生成三氯异氰尿酸,下列说法正确的是
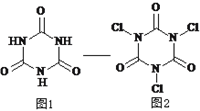
A. 氰尿酸的分子式为C6N3O3H3
B. HClO的电子式为 ![]()
C. 该转化过程有机物发生还原反应
D. 氰尿酸和次氯酸反应的物质的量之比为2 : 3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-
B. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
C. 某溶液![]() 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+
D. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于合成氨工业:N2(g)+3H2(g)![]() 2NH3(g)+QkJ(Q>0),下列说法正确的是( )
2NH3(g)+QkJ(Q>0),下列说法正确的是( )
A.1molN2和3molH2的总键能大于2molNH3的总键能
B.使用铁触媒作为催化剂对Q值的大小无影响
C.用水吸收NH3后,剩余N2和H2循环利用提高原料利用率
D.反应采用高温条件,可以用勒夏特列原理解释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示“强酸性或强碱性溶液可使品红溶液褪色”。某兴趣小组探究SO2使品红溶液褪色的原因,实验如下。
Ⅰ.探究体现漂白性的主要微粒
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中。观察到前者褪色而后者不褪色。
实验二:
| 试管中的液体 | 现象 |
a.0.1mol/L SO2溶液(pH=2) | 溶液逐渐变浅,约90s后完全褪色 | |
b.0.1mol/LNaHSO3溶液(pH=5) | 溶液立即变浅,约15s后完全褪色 | |
c.0.1mol/LNa2SO3溶液(pH=10) | 溶液立即褪色 | |
d.pH=10 NaOH溶液 | 红色溶液不变色 | |
e.pH=2 H2SO4溶液 | 红色溶液不变色 |
(1)SO2水溶液中含![]() 的微粒有___。
的微粒有___。
(2)解释NaHSO3溶液显酸性的原因是___。
(3)实验d的目的是___。
(4)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是___。
Ⅱ.探究褪色过程的可逆性
甲同学:向a实验后的无色溶液中滴入NaOH溶液至pH=10时,溶液颜色不变。
乙同学:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红。
(5)实验方案合理的是___(选填“甲”或“乙”)。结合离子方程式说明其原因是___。
(6)丙同学利用SO2的还原性设计并完成了下列实验:向a实验后的无色溶液中滴入过量___(填编号),使溶液最终恢复红色。也得出结论:该褪色过程是可逆的。
A.稀硝酸 B.氯水 C.双氧水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下:
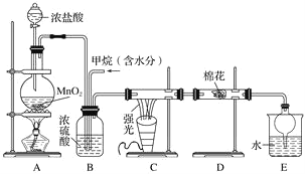
试回答下列问题:
(1)请写出C装置中生成CH3Cl的化学方程式:___________________________________。有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法________(填“正确”或“不正确”)。
(2)B装置有三种功能:①控制气流速率;②混匀混合气体;③________________。
(3)一段时间后发现D装置中的棉花由白色变为蓝色,则棉花上可能预先滴有________溶液。
(4)E装置中除盐酸外,还含有机物,从E中分离出盐酸的最佳方法为________(填字母)。
a.分液法 b.蒸馏法 c.结晶法
(5)将1 mol CH4与Cl2发生取代反应,充分反应后生成的CH3Cl、CH2Cl2、CHCl3、CCl4四种有机产物的物质的量依次增大0.1 mol,则参加反应的Cl2的物质的量为________,生成HCl的总物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g) ΔH<0,下列说法正确的是
2AB2(g) ΔH<0,下列说法正确的是
A. 达平衡后降低温度,混合气体平均相对分子质量减小
B. 使用催化剂能加快反应速率,缩短达平衡所需的时间且提高A2的转化率
C. 达平衡后升高温度并增大压强,有可能每一组分的百分含量都不改变,但平衡常数一定发生改变
D. 达平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应)。请回答下列问题:
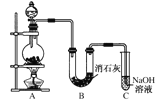
(1)A为实验室制氯气的发生装置,反应化学方程式为_________________________;某学生用12 mol·L-1的浓盐酸100 mL和足量的MnO2反应制Cl2,实际得到的Cl2________6.72 L(填“<”、“>”或“=”)。
(2)漂白粉将在U形管中产生,其化学方程式是_________________________________。
(3)此实验所得漂白粉的有效成分偏低。该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是________________。
②Cl2中含HCl,会发生反应2HCl+Ca(OH)2===CaCl2+2H2O,为避免此副反应的发生,可将装置作何改进______________________________。
(4) C装置的作用是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com