
【题目】合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)
(1)1 m3(标准状况)CH4按上式完全反应,产生H2_________mol。(精确到0.1)
(2)CH4和O2的反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g)
设CH4同时和H2O(g)及O2(g)反应。1 m3(标准状况)CH4按上述两式完全反应,产物气体的体积V m3(标准状况)的取值范围为________。
(3)CH4和H2O(g)及富氧空气(O2含量较高的空气)混合反应,产物气体组成如下表:
气体 | CO | H2 | N2 | O2 |
体积(L) | 25 | 60 | 15 | 2.5 |
计算该富氧空气中O2和N2的体积比,V(O2):V(N2)=________。
(4)若CH4和H2O(g)及(3)题中的富氧空气混合反应,产物气体中V(H2):V(N2)=3:1(合成氨反应的最佳比),则反应中的H2O(g)和富氧空气的体积比为_______。
【答案】133.9 3 <V<4 ![]() 1:15
1:15
【解析】
⑴根据第1个方程式,先算出甲烷的物质的量,再计算氢气的物质的量。
⑵用极限思维,假设全部发生第1个反应,算出气体量,假设全部发生第2个反应,算出气体量,根据极限思维,只能是两者之内。
⑶用方程式建立关系,依据生成一氧化碳和氢气的量建立方程式进行计算,再计算氧气和氮气的量的关系。
⑷用方程式建立关系,利用已知氢气与氮气的量之比为3:1建立方程式,再用⑶中的关系结合一起得出答案。
⑴1 m3(标准状况)CH4体积为1000L,其物质的量![]() ,按上式完全反应,产生H2物质的量44.64 mol×3 = 133.9mol,故答案为133.9 mol。
,按上式完全反应,产生H2物质的量44.64 mol×3 = 133.9mol,故答案为133.9 mol。
⑵1 m3(标准状况)CH4按照第1个方程式得出生成的气体体积为4 m3,按照第2个方程式得出生成的体积为3 m3,因此1 m3(标准状况)CH4按上述两式完全反应,产物气体的体积V m3(标准状况)的取值范围为3 <V<4,故答案为:3 <V<4。
⑶
建立关系 x + y = 25 ,3x + 2y =60,解得x = 10,y = 15,因此该富氧空气中O2和N2的体积比,V(O2):V(N2)=(0.5×15 + 0.5):15 =2:3,故答案为2:3。
⑷![]()
根据信息得出V(H2):V(N2)=(3z + 4d):1.5d = 3:1,则z:d= 1:6,则H2O(g)和富氧空气的体积比为z:2.5d =1:2.5×6 =1:15,故答案为:1:15。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O==Zn(OH)2+2Ag,其工作示意图如图。下列说法不正确的是:

A. Ag2O电极是正极
B. 电子由Zn电极流出,经过KOH溶液流入Ag2O电极
C. Zn电极的电极反应式:Zn-2e-+2OH-==Zn(OH)2
D. 溶液中OH-向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
N2(g)+CO2(g),测得各容器中c(NO)随反应时间t的变化情况如下表所示,下列说法正确的是
容器(温度) | t(min) c(molL-1) | 0 | 40 | 80 | 120 | 160 |
甲(400℃) | c(NO) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙(400℃) | c(NO) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
丙(T℃) | c(NO) | 2.00 | 1.40 | 1.10 | 1.10 | 1.10 |
A.达到平衡状态时,2v正c(NO)=v逆c(N2)
B.容器内压强不再改变说明反应已达平衡
C.丙容器中从反应开始到建立平衡的平均反应速率v c(NO)=0.01125 mol·L-1·min-1
D.由表格数据可知:T>400
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
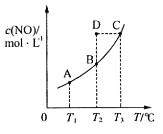
A. 该反应的△H>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.在T2时,若反应体系处于状态D,则此时![]()
D.若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应为Nz(g)+3H2(g) ![]() 2NH3(g),对其研究如下:在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1L 的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表;
2NH3(g),对其研究如下:在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1L 的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1) 前10min 中利用N2表示的反应速率为________
(2) 该温度下,此反应的平衡常数K=__________
(3) 该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正_______v逆(填“>”、“<”或“=”)。
(4) 该温度下,在上述平衡体系中再通入2molNH3,一段时间后,达到新的平衡。此时c(H2)____ 4.5mo1/L(填“>”、“<”或“=”)。
(5) 由上表中的实验数据计算得到“浓度-时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______。在此温度下,若起始充入4 mol Nz 和12 mol Hz,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_______。
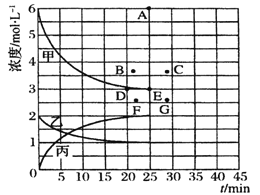
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种中学常见物质均含有同一种元素,且A为单质,有如图2所示的转化关系。则下列分析中不正确的是

A.若ABCDE中同一种元素的价态均不相同,则A为非金属单质
B.若A为金属钠,则由1mol D完全反应生成C时,一定有1mol电子转移
C.若A为非金属硫,则④的反应类型既可能为氧化还原反应,也可能为非氧化还原反应
D.若A为金属铁,则化合物C和D均可以由化合反应制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO42-、Cl-中的若干种,现取X溶液进行实验,实验过程及产物如图。下列说法正确的是( )
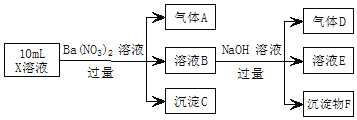
A.A是一种无色、无毒的气体
B.沉淀F为![]()
C.实验室可用排水法收集气体D
D.往溶液E中通入少量![]() ,有沉淀产生
,有沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年3月21日是第二十七届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图像如下所示:
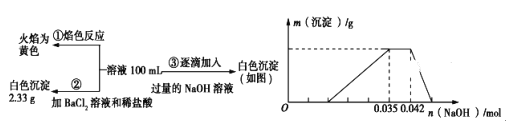
请回答下列问题:
(1)焰色反应是_________ (填“物理”或“化学”)变化;实验②中产白色沉淀是_________ (填化学式)。
(2)原溶液中一定存在的离子有________________,可能存在的离子有________________,一定不存在的离子有________________ (写化学式)。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为________________
(4)若通过实验确定原废水中c(Na+)=0.14 mol·L1,试判断原废水中NO3是否存在?________________(填“存在”“不存在”或“不确定”)。 若存在,c(NO3)=___________mol·L1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com