
����Ŀ��2009��10��1�գ��ҹ��ɹ��ٰ������ʮ���ı���������ı���ʽ��9���綯�����϶�����������Դ���������࣬չʾ���ۺϹ����������Ƽ���չˮƽ��ͬʱҲ˵����Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ�� CO(g) �� 2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��Ӧ�� CO2(g) �� 3H2(g)![]() CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
��������Ӧ������ԭ�Ӿ�����ԭ����� _____����������������������
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ɱ��������ж���H1 0 ������������������������������
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)�� 0.2 mol/L����CO��ת����Ϊ ����ʱ���¶�Ϊ �����ϱ���ѡ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H1����1275.6 kJ/mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2����566.0 kJ/mol
�� H2O(g) �� H2O(l) ��H3����44.0 kJ/mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ����
�������ͼ��ʾ�ĵ��װ�á��õ�������ĵ缫��ӦΪ ��

�ڹ���һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�Ļ�ѧ����ʽΪ
��
���𰸡���1���� I �ڣ� �� 80% 250��
��2�� CH3OH(l)+ O2(g) �� CO(g) + 2H2O(l) ��H����442.8 kJ�Mmol
��3���� O2+ 2H2O + 4e-= 4OH-
�� 2CH3OH + 3O2+ 4OH-= 2CO32-+ 6H2O
��������
��1���ٷ�ӦIֻ���ɼ״���������ɫ��ѧ˼�룬ԭ��������100%��
���ɱ������ݿ�֪���¶ȵ����ߣ�K��С��˵��ƽ�����ƣ�������Ӧ�Ƿ��ȷ�Ӧ����H1��0��
�� CO(g) �� 2H2(g) ![]() CH3OH(g)
CH3OH(g)
��c: 1 3 0
��c: 0.8 1.6 0.8
ƽc: 0.2 1.4 0.8
��CO��ת����Ϊ![]() =80%��K=
=80%��K=![]() =2.041�����ձ������ݿ�֪���¶�Ϊ250�棻
=2.041�����ձ������ݿ�֪���¶�Ϊ250�棻
��2����֪���� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H1����1275.6 kJ/mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2����566.0 kJ/mol
�� H2O(g) �� H2O(l) ��H3����44.0 kJ/mol
���ݸ�˹���ɣ��ɢ���![]() -����
-����![]() +����2�÷�ӦCH3OH(l)+ O2(g) �� CO(g) + 2H2O(l) ��H����442.8 kJ�Mmol��
+����2�÷�ӦCH3OH(l)+ O2(g) �� CO(g) + 2H2O(l) ��H����442.8 kJ�Mmol��
��3���ٸ�ȼ�ϵ���У������������õ��Ӻ�ˮ�������������ӣ��缫��ӦʽΪO2+ 2H2O + 4e-=4OH-��
�ڵ�ʧ������������£����缫��Ӧʽ��Ӽ��õ�ط�Ӧʽ�����Եõ�ط�ӦʽΪ2CH3OH + 3O2+ 4OH-= 2CO32-+ 6H2O��


 �ľ�ͼ���ʱ�ȷ�ϵ�д�
�ľ�ͼ���ʱ�ȷ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��������������Ƶú�ʹ�ý���п�Ĺ��ң�һ������п��ZnS������SiO2������FeS��CdS��PbS���ʣ�Ϊԭ���Ʊ�����п��������ͼ��ʾ��

��ؽ�������[c0(Mn+)=0.1 mol��L-1]�γ��������������pH��Χ���£�
�������� | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
��ʼ������pH | 1.5 | 6.3 | 6.2 | 7.4 |
������ȫ��pH | 2.8 | 8.3 | 8.2 | 9.4 |
�ش��������⣺
��1�����չ�������Ҫ��Ӧ�Ļ�ѧ����ʽΪ_______________________��
��2������1����Ҫ�ɷֳ�SiO2���___________���������ӹ�����ZnO��������____________������ͨ��������������________________��
��3����Һ�е�Cd2+����п�۳�ȥ����ԭ���ӹ����з�Ӧ�����ӷ���ʽΪ_________________��
��4���������п��Һ�Ʊ�����пʱ�������ĵ缫��ӦʽΪ______________������п��ĵ��Һ�ɷ���_______�������ʹ�á�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������л�����������ա�
�� C2H4 �� C2H2 �� ![]() ��
��![]()
�� ![]() ��
��![]() ��
��![]() ��
��  �ᷴ��2����ϩ
�ᷴ��2����ϩ
��1����~���У����ڱ���ͬϵ�����____������ţ���ͬ����
��2���ڵĵ���ʽΪ___________��
��3���ܵ�ϵͳ����Ϊ ___________��
��4����Ľṹ��ʽΪ __________��
��5���۱�����KMnO4��Һ�������л�����Ľṹ��ʽΪ_____��__________��
��6�����ں˴Ź�����������_______��壻
��7���١� �ۡ� ��ķе��ɸߵ��͵�˳����____________��
��8��д���ݵĺ��б�������ݲ�ͬ����һ��ͬ���칹��Ľṹ��ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԭ���װ����ͼ��ʾ������ܷ�ӦΪ2Ag��Cl2��2AgCl������˵����ȷ����

A. ������ӦΪAgCl ��e����Ag ��Cl��
B. �ŵ�ʱ������Ĥ�Ҳ���Һ���д�����ɫ��������
C. ����NaCl��Һ�������ᣬ�����ܷ�Ӧ��֮�ı�
D. ����·��ת��0.01 mol e��ʱ������Ĥ�����Һ��Լ����0.02 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ���������Ʊ������������֤��β�������IJ�������װ�ã������豸���г̶ֹ�װ�þ���ȥ���������Ҫ��������и��⣬����װ�ÿ�����ѡ�ã���Ҫʱ���ظ�ѡ��
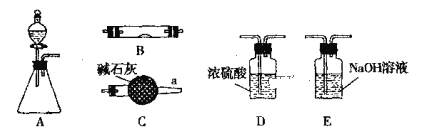
��1������ƿ��ʢװпƬ����Һ©����ʢװϡ���ᣬ����֤H2�Ļ�ԭ�Բ��������������
�ٵ���������˳��ΪA��D��B��B��Cʱ������ʹ��Bװ�ã�������ʢ��ҩƷ������CuO��____________��
�ڼ���װ�õ������Ժ����Bǰ������еIJ�����_________________ ��
��2������ƿ��ʢװNa2O2���壬��Һ©����ʢװŨ��ˮ��B��ʢװ����������ɽ��а��Ĵ��������䷴Ӧ����ΪNO��H2O��
�ٸ�����װ�ð������������������˳��A��C��B��C����д��B�а��Ĵ�������Ӧ����ʽ____________________________ ��
��װ��B�п��ܹ۲쵽��������_____________________________��
��3������ƿ��ʢװNa2SO3���壬��Һ©����ʢװH2SO4��Һ��B��ʢװNa2O2���壬��̽��SO2������������Ʒ�Ӧʱ�Ƿ���O2���ɡ�������������װ�õ�����˳��Ϊ��A��D��B��E������ʵ������ش����⣺
�������������ľ������E�ĵ��ܿڣ�ľ����ȼ��SO2������������������ʣ���Ӧ�ķ���ʽ����Ϊ��____________________��
������E�ĵ��ܿ�δ�ռ����κ����壬SO2ֻ���ֻ�ԭ�ԣ���Ӧ�ķ���ʽ����Ϊ��____________________��
��װ��B�й۲쵽��������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
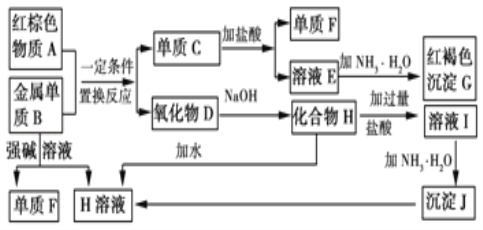
����Ŀ����ͼ����ѧ��ѧ�г������ʵ�ת����ϵ���������ʺͷ�Ӧ������ȥ��
��ش��������⣺
(1)����A�Ļ�ѧʽΪ_____��
(2)д������B��ǿ����Һ��Ӧ�����ӷ���ʽ_____��������D��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ_____��
(3)��ҺE�м��백ˮʱ�������ɰ�ɫ����L��L���ձ�Ϊ���ɫ����G��д��L��ΪG�Ļ�ѧ��Ӧ����ʽ_____��
(4)��ҺE���ڷ������ױ��ʣ�д��������ҺE�Ƿ���ʵ�ʵ�������������_____��Ϊ�˷�ֹ��ҺE�ı��ʣ�������Һ�м���_____�������ӷ���ʽ˵��______________
(5) ��3.06 g����þ�Ļ�����ĩ����100 mL������,ǡ����ȫ��Ӧ,���õ���״����3.36 L H2����úϽ����������ʵ���_____,��Ӧ����Һ��Cl-�����ʵ���Ũ��_____(�ٶ���Ӧ�����Ϊ100 mL)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������һ�ּ�ǿ�����������Ȼ��������������ᣨͼ1�����������һ��pH�·�Ӧ���Ʊ������������ᣨͼ2������ԭ����ȫ��Ӧ���������������ᣬ����˵����ȷ����
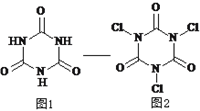
A. ������ķ���ʽΪC6N3O3H3
B. HClO�ĵ���ʽΪ ![]()
C. ��ת�������л������ԭ��Ӧ
D. ������ʹ����ᷴӦ�����ʵ���֮��Ϊ2 : 3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѱ���Ϊ��21���͵Ľ��������ɳ��ֶ��ֻ��ϼۡ�������+4�۵�Ti��Ϊ�ȶ���
��1����̬Tiԭ�ӵļ۵��ӹ����ʾʽΪ_______________��
��2����֪�����ܣ�I2��Ti����1310kJ/mol��I2��K����3051kJ/mol��I2��Ti����I2��K������ԭ��Ϊ________��
��3����ij���������ڴ���ϩ���ۺϣ������ͼ��ʾ��
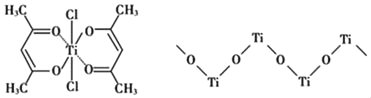
���ѵ���λ��Ϊ_____��̼ԭ�ӵ��ӻ�����_____��
�ڸ�������д��ڵĻ�ѧ����___________������ĸ��ţ���
a�����ӽ� b����λ�� c�������� d�����ۼ� e�����
��4����֪TiO2��Ũ���ᷴӦ�����������ѣ��������Ѿ�����������Ϊ��״�ۺ���ʽ�����ӣ��ṹ����ͼ��ʾ���������ӻ�ѧʽΪ________��������SO42���Ŀռ乹��Ϊ____��
��5������±���γɵĻ������۷е����±���ʾ��
TiCl4 | TiBr4 | TiI4 | |
�۵�/�� | ��24.1 | 38.3 | 155 |
�е�/�� | 136.5 | 233.5 | 377 |
���� TiCl4��TiBr4��TiI4���۵�ͷе����һ���仯���ɵ�ԭ���ǣ�_____��
��6����֪TiN����ľ����ṹ����ͼ��ʾ�����þ������ܶ���g/cm3�������ӵ�����ֵΪNA������Tiԭ����Nԭ�ӵ��������Ϊ________pm�����ú�����NA�Ĵ���ʽ��ʾ��
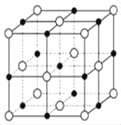
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ںϳɰ���ҵ��N2(g)+3H2(g)![]() 2NH3(g)+QkJ(Q>0)������˵����ȷ���ǣ� ��
2NH3(g)+QkJ(Q>0)������˵����ȷ���ǣ� ��
A.1molN2��3molH2���ܼ��ܴ���2molNH3���ܼ���
B.ʹ������ý��Ϊ������Qֵ�Ĵ�С��Ӱ��
C.��ˮ����NH3��ʣ��N2��H2ѭ���������ԭ��������
D.��Ӧ���ø�����������������������ԭ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com