
| A. | 羟基的电子式 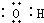 | B. | 丙烯的球棍模型 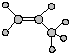 | ||
| C. | 乙炔的电子式  | D. | 乙酸的实验式 C2H4O2 |
分析 A、羟基是电中性基团,氧原子与氢原子以1对共用电子对连接;
B、球棍模型是用小球和小棍来表示原子和共价键的模型;
C、乙炔分子中存在碳碳三键,碳碳三键的表示方法错误;
D、实验式是物质组成的最简式,是用元素符号表示化合物分子中元素的种类和各元素原子个数的最简整数比的式子.
解答 解:A、羟基是电中性基团,氧原子与氢原子以1对共用电子对连接,电子式为 ,故A错误;
,故A错误;
B、球棍模型是用小球和小棍来表示原子和共价键的模型,故丙烯的球棍模型为 ,故B正确;
,故B正确;
C、乙炔分子中存在碳碳三键,乙炔正确的电子式为: ,故C错误;
,故C错误;
D、乙酸的分子式为:C2H4O2,实验式为:CH2O,故D错误;
故选C.
点评 本题考查了结构简式、球棍模型、电子式等的书写,应注意区分球棍模型和比例模型,难度不大.


科目:高中化学 来源: 题型:解答题
 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题: (若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
(若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维应避免在强碱环境中使用 | |
| B. | 船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 部分卤代烃可用作灭火剂 | |
| D. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
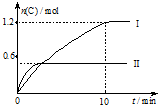 在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1
在2L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1| 实验序号 | 温度 | 起始物质的量 | |
| A | B | ||
| Ⅰ | 600℃ | 1mol | 3mol |
| Ⅱ | 800℃ | 1.5mol | 0.5mol |
| A. | 实验 I中,10 min内平均反应速率v(B)=0.06 mol•L-1•min-1 | |
| B. | 上述方程式中,a<0 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 molB,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
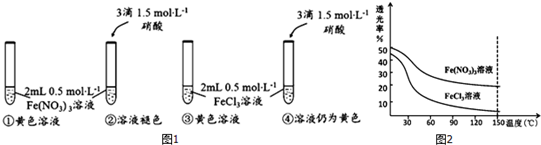
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的种类由原子核内质子数、中子数决定 | |
| B. | 元素的种类由原子核内质子数、中子数决定 | |
| C. | 32He代表原子核内有2个质子和3个中子的氦原子 | |
| D. | 178O和188O原子的核外电子数是前者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )
下列“试剂”和“试管中的物质”不能完成“实验目的”的是( ) | 实验目的 | 试剂 | 试管中的物质 | |
| A | 浓度对硫酸的性质有影响 | Fe | ①稀硫酸;②浓硫酸 |
| B | 羟基对苯环活性有影响 | 饱和溴水 | ①苯;②苯酚 |
| C | 甲基对苯环活性有影响 | 酸性KMnO4溶液 | ①苯;②甲苯 |
| D | 碳酸钠溶液碱性比碳酸氢钠溶液强 | 酚酞溶液 | ①碳酸钠溶液 ②碳酸氢钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com