
 2PbSO4+2H2O据此判断下列叙述
2PbSO4+2H2O据此判断下列叙述A.放电时负极电极反应式为:PbO2+4H+ + SO42-+2e- PbSO4+2H2O PbSO4+2H2O |
B.充电时阴极电极反应式为:PbSO4+2e- Pb+SO42- Pb+SO42- |
| C.充电时,若要使1molPbSO4转变为Pb和PbO2,则需要通过2mol电子 |
| D.放电时,H+向负极移动 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
 ;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。
;若反应过程中转移了0.3mol电子,则氧化产物的质量是 g。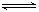
 Al(OH)4-+ H+ ②NH3+H2O
Al(OH)4-+ H+ ②NH3+H2O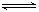 NH4+ + OH-
NH4+ + OH-查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
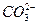 +7H2O;通入氧气的另一极,其电极反应式是2O2+4H2O+8e-====8OH-,下列叙述正确的是( )
+7H2O;通入氧气的另一极,其电极反应式是2O2+4H2O+8e-====8OH-,下列叙述正确的是( )| A.通入甲烷的电极为正极 |
| B.正极发生氧化反应 |
| C.该电池使用一段时间后应补充氢氧化钾 |
| D.燃料电池工作时,溶液中的阴离子向正极移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电池负极(锌筒)的电极反应式为:Zn-2e-=Zn2+ |
| B.电池正极(石墨)的电极反应式为:2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④ | B.②③ | C.③ | D.④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
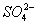
 2PbSO4+2H2O,则下列说法正确的是( )
2PbSO4+2H2O,则下列说法正确的是( ) 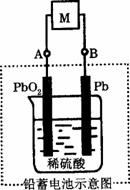
| A.放电时,电流方向由B过M到A |
| B.充电时,铅蓄电池的正极应与充电器电源的负极相连 |
C.放电时,正极反应是Pb-2e-+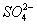 ====PbSO4 ====PbSO4 |
D.充电时,阳极反应是PbSO4-2e-+2H2O====PbO2+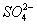 +4H+ +4H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.依原电池的原理设计出化学电源 |
| B.原电池是化学电源的雏形 |
| C.原电池输出电能的能力取决于组成原电池的负极材料的活泼性 |
| D.氧化还原反应所释放出的化学能是化学电池的能量来源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com