
【题目】(1)AgNO3的水溶液呈________________(填“酸”、“中”、“碱”)性,常温时的pH_____7(填“>”、“=”、“<”),原因是(用离子方程式表示):_______________________________________________________________________________________;
实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以____________(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈_______性 ,原因是(用离子方程式表示):_____________________________________________________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是____________________。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的______________。
【答案】酸 < Ag++ H2O![]() AgOH + H+ 抑制 酸 Al3++3H2O
AgOH + H+ 抑制 酸 Al3++3H2O![]() Al(OH)3+3H+ Al2O3 NaOH
Al(OH)3+3H+ Al2O3 NaOH
【解析】
(1)AgNO3是强酸弱碱盐,阴离子水解,水溶液呈酸性,pH小于7。水解方程式是Ag++ H2O![]() AgOH + H+;硝酸银溶于水,银离子水解,溶液显酸性。所以将AgNO3固体先溶于较浓的硝酸中的目的是抑制银离子的水解;
AgOH + H+;硝酸银溶于水,银离子水解,溶液显酸性。所以将AgNO3固体先溶于较浓的硝酸中的目的是抑制银离子的水解;
(2)氯化铝溶于水,铝离子水解,溶液显酸性,水解方程式是Al3++3H2O![]() Al(OH)3+3H+。水解吸热,加热促进水解,且生成的氯化氢挥发,进一步促进水解,所以最终得到的是氢氧化铝,灼烧得到氧化铝;
Al(OH)3+3H+。水解吸热,加热促进水解,且生成的氯化氢挥发,进一步促进水解,所以最终得到的是氢氧化铝,灼烧得到氧化铝;
(3)硫化钠溶于水,硫离子水解,溶液显碱性。所以在配制硫化钠溶液时,为了防止发生水解,可以加入少量的氢氧化钠。


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1molA、2molB,此时甲、乙的容积均为2L(连通管体积忽略不计)。在T℃时,两容器中均发生下述反应:A(g)+2B(g)![]() 2C(g)+3D(g)△H<0。达平衡时,乙的体积为2.6L,下列说法正确的是( )
2C(g)+3D(g)△H<0。达平衡时,乙的体积为2.6L,下列说法正确的是( )
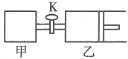
A. 甲中反应的平衡常数小于乙
B. 当乙中A与B的体积分数之比为1:2时,反应达到平衡状态
C. 平衡时甲容器中A的物质的量小于0.55mol
D. 若打开活塞K,达平衡时乙容器的体积为3.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
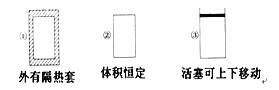
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.23g Na与足量H2O反应完全后可生成NA个H2分子
B.标准状况下,11.2L H2O中含有的氧原子数为0.5NA
C.5.6g铁与足量盐酸反应转移的电子数为0.3NA
D.16g O2含有的氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等)制备FeSO4·7H2O(绿矾)的流程如下:
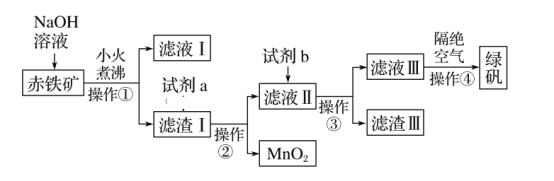
(1)实验室中操作①的名称为____。所需的玻璃仪器有烧杯、______、_____。
(2)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为_______________________。
(3)加入滤渣Ⅰ中的试剂a是___________,滤液Ⅱ中的主要金属阳离子有_____。
(4)试剂b为__________________。
(5)滤渣Ⅲ中的主要成分是____________。操作④隔绝空气的目的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯原子对O3的分解有催化作用:
O3+Cl === ClO+O2 ΔH1
ClO+O === Cl+O2 ΔH2
大气臭氧层的分解反应是O3+O===2O2 ΔH,该反应的能量变化如图:
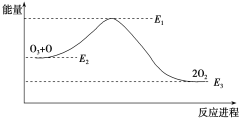
下列叙述中,正确的是( )
A. 反应O3+O===2O2的ΔH=E1-E3
B. O3+O===2O2是吸热反应
C. ΔH=ΔH1+ΔH2
D. 2O2===O3+O 是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个定容的密闭容器中进行如下反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为0.1 mol·L-1、0.05 mol·L-1和0.3 mol·L-1。当反应达平衡时不可能存在的数据正确的是
2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为0.1 mol·L-1、0.05 mol·L-1和0.3 mol·L-1。当反应达平衡时不可能存在的数据正确的是
A. c(SO2)=0.25 mol·L-1 B. c(O2)=0.12 mol·L-1
C. c(SO2)+c(SO3)=0.15 mol·L-1 D. c(SO3)+c(O2)=0.3 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com