
【题目】在一个定容的密闭容器中进行如下反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为0.1 mol·L-1、0.05 mol·L-1和0.3 mol·L-1。当反应达平衡时不可能存在的数据正确的是
2SO3(g)。已知反应过程中的某一时间SO2、O2和SO3的浓度分别为0.1 mol·L-1、0.05 mol·L-1和0.3 mol·L-1。当反应达平衡时不可能存在的数据正确的是
A. c(SO2)=0.25 mol·L-1 B. c(O2)=0.12 mol·L-1
C. c(SO2)+c(SO3)=0.15 mol·L-1 D. c(SO3)+c(O2)=0.3 mol·L-1
【答案】C
【解析】
该题2SO2(g)+O2(g)2SO3(g)是一个可逆反应。假设SO2(g)和O2(g)全部转化为SO3(g),
2SO2(g)+O2(g)2SO3(g)
初始(molL-1) 0.1 0.05 0.3
变化(molL-1) 0.1 0.05 0.1
终了(molL-1) 0 0 0.4
假设SO3(g)全部转化为SO2(g)和O2(g)
2SO2(g)+O2(g)2SO3(g),
初始(molL-1)0.1 0.05 0.3
变化(molL-1)0.3 0.15 0.3
终了(molL-1)0.4 0.2 0
该反应是一个可逆反应,无论向正反应方向进行还是向逆反应方向进行,实际不可能100%转化。综上情况可知:0<c(SO2)<0.4molL-1 ;0<c(O2)<0.2molL-1 ;0<c(SO3)<0.4molL-1 ;A、SO2为0.25molL-1在范围内,符合条件,故A不选;B、O2为0.12molL-1范围内,符合条件,故B不选;C、硫元素不守恒,应有c(SO2)+c(SO3)=0.4molL-1,故C选;D、0<c(SO3)+c(O2)<0.6molL-1,所以c(SO3)+c(O2)=0.3molL-1在范围内,符合条件,故D不选;故选C。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】常温下,将AgNO3溶液分别滴加到浓度均为0.01mol/L的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、SeO32-用Xn-表示,不考虑SeO32-的水解)。下列叙述正确的是

A. Ksp(Ag2SeO3)的数量级为10-10
B. d点对应的AgBr溶液为不饱和溶液
C. 所用AgNO3溶液的浓度为10-3 mol/L
D. Ag2SeO3(s)+2Br-(aq)==2AgBr(s)+SeO32- (aq)平衡常数为109.6,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】六氨氯化镁 (MgCl2·6NH3)具有极好的可逆吸、放氨特性,是一种优良的储氨材料。某研究小组在实验室以菱镁矿(主 要成分 MgCO3,含少量 FeCO3等杂质)为原料制备六氨氯化镁,实验流程图如下:
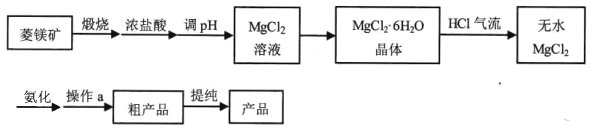
其中氨化过程装置示意图如下:
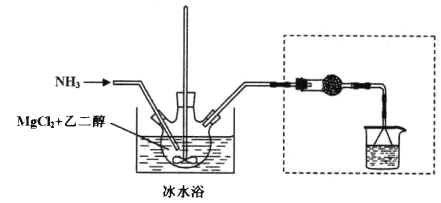
己知:(1)与Mg2+结合能力: H2O>NH3>HOCH2CH2OH>CH3OH
(2)相关物质的性质见下表:
物质名称 | 氨气的溶解性 | 氯化镁的溶解性 | 六氨氯化镁的溶解性 |
水 | 易溶 | 易溶 | 易溶 |
甲醇(沸点65℃) | 易溶 | 易溶 | 难溶 |
乙二醇(沸点197℃) | 易溶 | 易溶 | 难溶 |
请回答:
(1)调 pH适合的物质是________ (填化学式)。
(2)在空气中直接加热MgCl2·6H2O晶体得不到纯的无水MgCl2,原因是________(用化学方程式表示)。
(3)虚框内装置的作用: _______,操作a的名称是_________。
(4)提纯操作中,下列洗涤剂最合适的是_______。
A.冰浓氨水 B.乙二醇和水的混合液
C.氨气饱和的甲醇溶液 D.氨气饱和的乙二醇溶液
(5)制得产品后,该科研小组对产品的成分进行测定,其中氯离子含量检测方法如下:
a.称取1.420g样品,加足量硫酸溶解,配制成250mL溶液;
b.量取25.00mL待测液于锥形瓶中;
c.用0.2000mol/LAgNO3标准溶液滴定至终点,记录消耗AgNO3标准溶液的体积;
d.重复b、c操作2~3次,平均消耗AgNO3标准溶液10.00mL。
① 配制样品溶液时加硫酸的原因___________。
② 该样品中氯离子百分含量为____________。
③ 将氯离子百分含量实验值与理论值 (36.04%)相比较,请分析造成此结果的可能原因有_________(己知滴定操作正确、硫酸根离子对检测无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池是绿色环保型电池,电池的总反应为:Li1-xFePO4+LixC6= LiFePO4+C6。
(1)LiFepO4中Fe2+的价电子排布图(轨道表达式)为___________,该电池反应物中涉及第二周期的元素的第一电离能由大到小的顺序是___________(用元素符号表示)。
(2)H3PO4和H2CO3中P和C原子的杂化方式_____(填“相同”或“不相同”)。PO43-的空间结构为___________。
(3)石墨可用作锂离子电池的负极材料,Li+嵌人石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物。某石墨嵌入化合物的平面结构如右图所示,则x=___________;若每个六元环都对应一个L i+,则化学式为___________。

(4)某金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,阴离子是由12个硼原子和12个氢原子所构成的离子团。阴离子在晶胞中位置如图所示,其堆积方式为___________,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为___________(用最简整数比表示)。假设晶胞边长为a nm,则两个最近的Li+的距离为___________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 金属氧化物都是碱性氧化物
B. 溶于水电离出H+的物质都是酸
C. 在氧化还原反应中,金属单质作反应物时一定是还原剂
D. 阳离子只有氧化性,阴离子只有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1。请回答下列问题:

(1)图中A、C分别表示________、_________,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是_________________________。
(2)图中△H=____________kJ·mol-1。
(3)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=_________υ(SO3)=___________。
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求写出计算过程)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。

下列说法正确的是
A. 卤素单质(X2)与水反应均可生成两种酸
B. 用电子式表示MgF2的形成过程为: ![]()
C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g),ΔH=-277kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是
混合物 | 酸 | 盐 | 化合物 | |
A | CuSO4·5H2O | H2SO4 | NaCl | 盐酸 |
B | 碱石灰 | 醋酸 | 生石灰 | Na2O |
C | KNO3晶体 | NH4Cl | Cu2(OH)2CO3 | NaOH |
D | 澄清石灰水 | HNO3 | NaHSO4 | NaHCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1mol X和2mol Y 加入2L的恒容密闭容器中发生反应:X(g)+2Y(g) ![]() 2 Z(g) △H=-akJ/mol,10min后测得Y的物质的量为1.4mol。下列说法不正确的是
2 Z(g) △H=-akJ/mol,10min后测得Y的物质的量为1.4mol。下列说法不正确的是
A.10min内Y的平均反应速率为0.03molL-1min-1
B.10min内容器中的气体密度逐渐减小
C.10min内反应放出的热量一定小于a kJ
D.升高容器温度,反应速率ν(正)、ν(逆)均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com