
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl— = AuCl4— | >>1 |

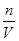 =
=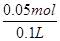 ="0.5" mol/L,亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,根据原子守恒,亚铁离子的物质的量是:
="0.5" mol/L,亚铁离子和氢氧化钠反应生成氢氧化亚铁,在空气中更易被氧化为氢氧化铁,受热分解生成的氧化铁的质量是4.8g,根据原子守恒,亚铁离子的物质的量是: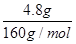 ×2
×2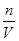 =
=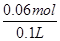 =0.6mol/L,故答案为;0.5;0.6.
=0.6mol/L,故答案为;0.5;0.6.

科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:2:3 | B.3:2:1 | C.6:3:2 | D.6:3:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
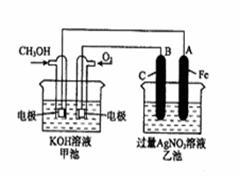
科目:高中化学 来源:不详 题型:单选题
| A.负极 | B.正极 | C.阴极 | D.阳极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该装置中Cu极为正极 |
| B.当铜极的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为2.24L |
| C.b极反应的电极反应式为:H2-2e-=2H+ |
| D.一段时间后锌片质量减少 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有②④⑤⑦ | B.只有①④⑥⑦ | C.只有②③⑤⑧ | D.只有①③⑥⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com