
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_______。
(2)氯气和FeBr2反应实验操作及现象如下:

据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
(3)丙同学继续设计实验,探究反应过程:

①转移到大试管前CCl4液体中呈红棕色的物质是___________。
②丙通过此实验可得出结论:________。
【答案】 (1)①50mL容量瓶、烧杯(多答“量筒”亦可) ②Fe3+ 4Fe2++O2+4H+=4Fe3++2H2O ⑵①Cl2+ 2Fe2+=2CL-+ 2Fe3+ ② 溶液中含有的Fe3+可与I-反应生成I2使淀粉变蓝 ③静置后,上层溶液为黄色,下层溶液无色
⑶①Br2 ②少量Cl2能与Br-反应,生成的Br2会继续氧化溶液中的Fe2+
【解析】
(1)①配制50mL1.0molL-1FeBr2溶液,步骤有计算,称量,溶解,转移,洗涤转移,定容,摇匀等,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、50mL容量瓶;②亚铁离子在溶液中易被空气中的氧气氧化为Fe3+,使溶液略显黄色,发生反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O;
(2)①Cl2氧化Fe2+生成Fe3+发生反应的离子方程式是Cl2+ 2Fe2+=2C1-+ 2Fe3+;
②溶液中含有的Fe3+有强氧化性,也能氧化I-生成I2使淀粉变蓝,故乙同学认为不能证明Cl2和Br-发生反应;
③如果静置后,看到上层溶液为黄色说明溶液中含有Fe3+,下层溶液无色说明无Br2,即可证明少量Cl2只与Fe2+反应,不与Br-反应;
(3)①Br2的CCl4溶液呈红棕色,说明转移到大试管前CCl4液体中呈红棕色的物质是Br2;
②丙实验中先有Br2生成,后利用Br2氧化Fe2+得Fe3+,故丙实验可得结论是少量Cl2能与Br-反应,生成的Br2会继续氧化溶液中的Fe2+。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】还原2.4×10﹣3 mol XO(OH)3+到X元素的低价态时,消耗0.2molL﹣1的Na2SO3溶液30mL,则X元素反应后的价态是( )
A.+1
B.﹣1
C.0
D.﹣2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。

相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
A. 1mol —CH3(甲基)中含有的电子数为10NA
B. 标准状况下,22.4 L C3H8中含共价键的数目为8 NA
C. 标准状况下,22.4 L苯中含C—H数目为6 NA
D. 184g 甘油与足量的钠反应生成H2的数目为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物结构和性质的说法正确的是
A. 乙烯、苯和乙酸均能与氢气发生加成反应
B. 某芳香烃的分子式为C10H14,常温下它可使酸性KMnO4溶液褪色,且分子结构中只有一个侧链,符合条件的烃有4种
C. 1 mol的有机物(结构如右图)最多能与含5mol NaOH的水溶液完全反应

D. 蛋白质盐析会使蛋白质失去生理活性,加热、紫外线照射等措施可使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8.985g 含少量氯化钠的碳酸氢钠固体加热一段时间,再加入足量盐酸完全反应。有关叙述正确的是
A. 固体分解越完全,消耗盐酸的量越少
B. 共生成0.1mol二氧化碳,固体中氯化钠为5.85g
C. 固体中碳酸氢钠含量越多,钠元素的含量也越多
D. 溶液中的钠离子为0.11mol,原固体中的碳酸氢钠为8.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种基础化工原料,通过电解饱和食盐水可以制得NaOH、H2、Cl2。
完成下列填空:
(1)写出电解饱和食盐水的化学方程式_____________________。
(2)氯原子的最外层电子排布式为_______,氯离子核外有_____种运动状态不同的电子。
(3)氯气压缩成为液氯属于________变化(选填“物理”“化学”)。常用浓氨水来检查输氯管道是否泄漏,泄漏处会观察到大量的白烟(NH4Cl),还生成一种无色无味的单质气体,写出此反应的化学方程式并标出电子转移的方向和数目__________________。
(4)氯气可用来标定碘水中碘单质的含量:5Cl2+I2+6H2O→10HCl+2HIO3。测定时可用气体流量计准确控制氯气的体积,以淀粉做指示剂来指示反应终点,反应终点时的现象是___________________。
用氯气标定一定体积碘水中碘单质的浓度,进行三次平行实验,数据记录见下表:
碘水的体积(mL) | 标况下氯气的体积(mL) |
500 | 56 |
500 | 55 |
500 | 57 |
则上述碘水中碘单质的浓度为____mol/L,假定碘水的实际浓度为1.02×10-3mol/L,则实验的相对误差为_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤和石油不仅是重要的矿物能源,更可以通过综合利用得到多种有机化工产品。
煤干馏后可得到焦炭、煤焦油、粗氨水和焦炉气等。焦炭可通过以下途径制取聚氯乙烯等化工产品。

完成下列填空:
(1)氯乙烯转化为聚氯乙烯的化学方程式____________________。
(2)HC≡C-CH=CH2与正四面体烷![]() 的关系是____(选填“同系物”“同分异构体”)。若分别完全燃烧等质量的HC≡C-CH=CH2和乙炔,所需氧气的量__________ (选填“前者多”“后者多”“一样多”)。
的关系是____(选填“同系物”“同分异构体”)。若分别完全燃烧等质量的HC≡C-CH=CH2和乙炔,所需氧气的量__________ (选填“前者多”“后者多”“一样多”)。
(3)检验C2H4O中是否含有醛基的实验方法是_________________。
乙烯是石油化工最重要的基础原料,下图是工业合成物质C的流程:
![]()
完成下列填空:
(4)A与浓硫酸在共热条件下制取乙烯的反应类型是_________。
(5)B的分子式为C2H4O2,与纯碱反应能生成二氧化碳气体,写出A+B→C的化学方程式____________________。
(6)乙烯可用来合成聚乙二酸乙二酯![]() 。以乙烯为原料,无机试剂任选,设计聚乙二酸乙二酯的合成路线。
。以乙烯为原料,无机试剂任选,设计聚乙二酸乙二酯的合成路线。
(合成路线常用的表示方式为:![]() )
)
_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
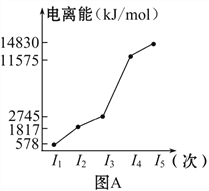
【题目】图表法、图像法是常用的科学研究方法。
(1)短周期某主族元素M的电离能情况如图A所示。则M元素位于周期表的第________族。
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出①第________族元素氢化物的沸点变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是②________,理由是③______________

(3)如图是对羟基苯甲醛的结构简式![]() ,其分子间的氢键可表示为_____________
,其分子间的氢键可表示为_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com