
【题目】下列有关有机化合物结构和性质的说法正确的是
A. 乙烯、苯和乙酸均能与氢气发生加成反应
B. 某芳香烃的分子式为C10H14,常温下它可使酸性KMnO4溶液褪色,且分子结构中只有一个侧链,符合条件的烃有4种
C. 1 mol的有机物(结构如右图)最多能与含5mol NaOH的水溶液完全反应

D. 蛋白质盐析会使蛋白质失去生理活性,加热、紫外线照射等措施可使蛋白质变性
科目:高中化学 来源: 题型:
【题目】把过量铁屑加入氯化铁和氯化铜的混合溶液中,反应结束后,称得固体质量与所加铁屑的质量相等,则原溶液中( )
A. 7:2 B. 3:2 C. 2:3 D. 2:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁在工业、医疗等领域均有重要用途。某化学小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了回收其中镁的工艺流程:
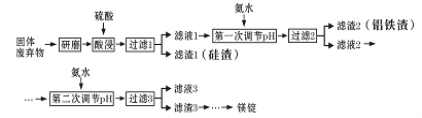
(1)酸浸前,将固体废弃物研磨的目的是_______,为达到此目的,还可以采取的措施是_____(任写一条)。
(2)酸浸时,生成滤渣I的离子方程式为_________。
(3)第一次调节pH的目的是_____。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为 _________ 。已知Ksp[Fe(OH)3 ]=4×10-38,Ksp[Al(OH)3 ]=1×10-33.
(4)设计简单方案分离滤渣2,简述实验过程:______。
(5)滤液3中可回收利用的物质主要是_____(填化学式),其阳离子的电子式为 _______。
(6)写出工业上从滤渣3中获得镁锭的所有反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似,Zn(OH)2能溶于NaOH溶液。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)实验中的过滤操作所用到的玻璃仪器为____________________。
(2)加入ZnO调节pH=a的目的是____________________,a的范围是___________。
(3)由不溶物E生成溶液D的化学方程式为______________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是___________,__________,过滤。
(5)若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________。
(6)若废旧黄铜的质量为a g,最终得到的胆矾晶体为b g,则该黄铜中铜元素的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应A2 + B2 ![]() 2AB △H= Q kJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
2AB △H= Q kJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是

A. Q >0
B. A2、B2中最少有一种是气态物质
C. b对应的平衡状态时化学反应速率比c对应的平衡状态时化学反应速率大
D. AB一定是气体物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_______。
(2)氯气和FeBr2反应实验操作及现象如下:

据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
(3)丙同学继续设计实验,探究反应过程:

①转移到大试管前CCl4液体中呈红棕色的物质是___________。
②丙通过此实验可得出结论:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,对形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为____________。
(2)上述元素最高价氧化物对应的水化物酸性最强的是_______(写化学式),非金属气态氢化物还原性最强的是___________(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有_______(写出其中两种物质的化学式)。
(4)ZX的电子式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的工业制法中,不正确的是:
A. 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
B. 制镁:用海水为原料,经一系列过程制得氯化镁固体,电解熔融的氯化镁得镁
C. 制铁:以铁矿石为原料,CO还原得铁
D. 制漂白粉:将氯气通入石灰乳中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com