
����Ŀ����һ�������£���ӦA2 + B2 ![]() 2AB ��H= Q kJ/mol�ķ�Ӧʱ����������AB������������AB%���Ĺ�ϵ��ͼ��ʾ������a��bΪ��ͬ�¶�ʱ�ķ�Ӧ���ߣ������������䣩��cΪ��t3ʱ�̿�ʼ��С�����ݻ����¶Ȳ��䣩�ı仯���ߡ������й�˵����ȷ����
2AB ��H= Q kJ/mol�ķ�Ӧʱ����������AB������������AB%���Ĺ�ϵ��ͼ��ʾ������a��bΪ��ͬ�¶�ʱ�ķ�Ӧ���ߣ������������䣩��cΪ��t3ʱ�̿�ʼ��С�����ݻ����¶Ȳ��䣩�ı仯���ߡ������й�˵����ȷ����

A. Q >0
B. A2��B2��������һ������̬����
C. b��Ӧ��ƽ��״̬ʱ��ѧ��Ӧ���ʱ�c��Ӧ��ƽ��״̬ʱ��ѧ��Ӧ���ʴ�
D. ABһ������������
���𰸡�D
��������A.����ͼ��a�ķ�Ӧ���ʿ죬�¶ȸߡ������¶ȣ�AB�ĺ�����С��˵������Ӧ�Ƿ��ȷ�Ӧ������Q��0������B.��С�������������ѹǿ����AB�ĺ�����С��˵��ƽ�����淴Ӧ�����ƶ����������������С�ķ����ƶ�����ABΪ���塢A2��B2��ֻ��һ�������壬����C. ����ͼ��a�ķ�Ӧ���ʿ죬�¶ȸߣ�b��Ӧ��ƽ��״̬ʱ��ѧ��Ӧ���ʱ�c��Ӧ��ƽ��״̬ʱ��ѧ��Ӧ����С������D. ��С�������������ѹǿ����AB�ĺ�����С��˵��ƽ�����淴Ӧ�����ƶ����������������С�ķ����ƶ�����ABΪ���壬��ȷ����ѡD��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʵľ����У���ѧ��������ͬ����������Ҳ��ͬ����
A��SiO2��SO2 B��NaCl��HCl
C��CO2��H2O D��CH4��KCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ̼��ͭ��Cu2(OH)2CO3��������Ŀ��ﱦʯ��ȸʯ����Ҫ�ɷ֣�Ӧ�ù㷺����������ҵ�������������ͭ������л���ҵ�������л��ϳɴ����ȵȣ�ij��ѧС��Ϊ��̽����ʽ̼��ͭ��������������ʵ�Ӱ�죬���������ʵ�飺
���ԭ����ȡһ�������̼������Һ��0.5mol/L)��100mL�ձ��У����м��ȣ����º�����ͭ��Һ��5.00mL. 0.5mol/L)�ڲ��Ͻ�������һ���ٶ���μ��뵽����̼������Һ�У���Ӧ��ƽ���ֹ����ѹ���ˣ�ϴ�ӣ���ɣ����õ����ղ�Ʒ��ͬʱ������ų���
��1����Ӧԭ��Ϊ��________________��
��2��̽����Ӧԭ�������ȶԷ�Ӧ�����Ӱ�졣
�û�ѧС��������ṩ�Լ���֭����ʵ����˵����Ӧԭ�������Բ�Ʒ��Ӱ��
�ṩ�Լ���0.5mol/LNa2CO3��Һ��0.5mol/LCuSO4��Һ��
������д�±��Ŀհ״���
�� | �� | �� | �� | |
����ͭ��Һ���/mL | 2.0 | 2.0 | 2.0 | 2.0 |
̼������Һ���/mL | 1.6 | 2.0 | 2.8 | |
Na2CO3/CuSO4mol/��) | 0.8 | 1 | 1.4 |
��ͨ��ʵ�黭ͼ��֪������ֵΪ______����ʽ̼��ͭ������á�

��3����Ӧ�¶ȶԲ��ʵ�Ӱ��
����֧�Թ��и�����2.0mL0.5 mol/LCuSO4��Һ��ȡ��֧�Թܸ�����������ʵ��õ��ĺ���������0.5 mol /L Na2CO3��Һ�����������Թ��и�ȡһ֧�����Ƿքe�������¡�30����50����100���Ļ����������Ӻ�CuSO4��Һ����Na2CO3��Һ�����۲������֣�������ɫ�ֱ�Ϊ��ɫ��������ɫ����������ɫ��������ɫ�д��к�ɫ������ʵ����Ҳ����ͼ��ʾ����˼����Ϊʲô�¶ȹ��{���ʷ����½�_______����ʵ����ȷ�ʽΪ____________��
��4���������Ƶõļ�ʽ̼��ͭ������������
����ȷ������0.5g������Ʒ����300mL����ƿ�У�����5mL���ᣬ����ʹ���ܽ⣬����l00mLˮ����ϡ�͡�����2.5gKI��ϣ�����5���Ӻ������ε�����Һ����0.1mol/L�������������Һ���еζ�����_______ʱ����ζ����յ㡣
��Ӧ��ԭ����2Cu2++4I- =2CuI+I2�� I2+2S2O32-=2I-+S4O62-
��0.lmol/L���������40 mL����ô������ͭ�������ٷ���Ϊ________��
����Һ�ĵζ���Ϊ_______��������������Һ�൱�ڱ������ʵ���������λ��g/mL��mg/mL)(������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�SO2˵���в���ȷ������
A. SO2����Ⱦ�������к�����֮һ B. SO2�ڴ�������ˮ��Ӧ�������ᣬ��������
C. SO2��ʹ����ʯ��ˮ����� D. SO2��ʹƷ����Һ��ɫ��������Һ��ɫ�ָ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ�ǰ�����ڵ�һ���֡�
X | Z | ||
W | Y | R | |
��1��X���⻯��ķе���W���⻯��Ƚϣ��е�ϸߵ��ǣ�______________���ѧʽ����ԭ����_____________________��
��2��������ѡ����ѡ��X�Ļ�̬ԭ�ӵ������ԭ�ӹ����ʾʽ____________����һԭ�ӹ����ʾʽ������Ϊ��̬ԭ�ӵĹ����ʾʽ����Ϊ��������____________��������ţ���
A. 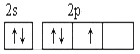 B.
B. 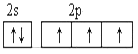
C������ԭ�� D�����ع���
��3������W��Y��RԪ��ԭ��ʧȥ�����һ��������Ҫ�����ɶൽ�ٵ�˳��Ϊ��_______________����Ԫ�ط��ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��л�������ṹ�����ʵ�˵����ȷ����
A. ��ϩ������������������������ӳɷ�Ӧ
B. ij�������ķ���ʽΪC10H14������������ʹ����KMnO4��Һ��ɫ���ҷ��ӽṹ��ֻ��һ����������������������4��
C. 1 mol���л���ṹ����ͼ��������뺬5mol NaOH��ˮ��Һ��ȫ��Ӧ

D. ������������ʹ������ʧȥ�������ԣ����ȡ�����������ȴ�ʩ��ʹ�����ʱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�ػ��ϼ���ԭ�������Ĺ�ϵͼ������˵����ȷ����

A. ԭ�Ӱ뾶��Z��Y��X
B. ��̬�⻯����ȶ��ԣ�R��W
C. WX3��ˮ��Ӧ�γɵĻ����������ӻ�����
D. Y��Z��������������Ӧ��ˮ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ʾ��ܷ����ӳɷ�Ӧ����
A. ��ϩ�������� B. �屽�ͻ����� C. ���Ӻ���ȩ D. ��ϩ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2(g)��3H2(g) ![]() 2NH3(g)�����������ܱ������з�Ӧ������������ʾ���ڻ�ѧƽ��״̬����(����)
2NH3(g)�����������ܱ������з�Ӧ������������ʾ���ڻ�ѧƽ��״̬����(����)
A. N2��H2��NH3��Ũ�ȱ�Ϊ1��3��2��״̬
B. ���������ܶȲ���ʱ����仯
C. ����1 mol N��N����ʱ����6 mol N��H����
D. ��λʱ��������a mol N2��ͬʱ������3a mol��H2��״̬
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com