
【题目】碱式碳酸铜(Cu2(OH)2CO3)是名贵的矿物宝石孔雀石的主要成分,应用广泛,如在无机工业中用于制造各种铜化合物,有机工业中用作有机合成催化剂等等,某化学小组为了探究碱式碳酸铜生成条件对其产率的影响,设计了如下实验:
设计原理:取一定体积的碳酸钠溶液(0.5mol/L)于100mL烧杯中,进行加热,恒温后将硫酸铜溶液(5.00mL. 0.5mol/L)在不断搅拌下以一定速度逐滴加入到上述碳酸钠溶液中,反应达平衡后,静止,减压过滤,洗涤,烘干,即得到最终产品,同时有气体放出。
(1)反应原理为:________________。
(2)探究反应原料用量比对反应产物的影响。
该化学小组根据所提供试剂设汁两个实验来说明反应原料用量对产品的影响
提供试剂:0.5mol/LNa2CO3溶液、0.5mol/LCuSO4溶液。
①请填写下表的空白处:
① | ② | ③ | ④ | |
硫酸铜溶液体积/mL | 2.0 | 2.0 | 2.0 | 2.0 |
碳酸钠溶液体积/mL | 1.6 | 2.0 | 2.8 | |
Na2CO3/CuSO4mol/比) | 0.8 | 1 | 1.4 |
②通过实验画图可知:当比值为______,碱式碳酸铜产量最好。

(3)反应温度对产率的影响
在三支试管中各加入2.0mL0.5 mol/LCuSO4溶液另取四支试管各加入由上述实验得到的合适用量的0.5 mol /L Na2CO3溶液。从这两列试管中各取一支将它们分別置于室温、30℃、50℃、100℃的环境中数分钟后将CuSO4溶液倒入Na2CO3溶液中振荡并观察现象,发现:沉淀颜色分别为蓝色沉淀,绿色沉淀、深绿色沉淀,绿色中带有黑色沉淀,实验结果也如上图所示,请思考,为什么温度过髙产率反而下降_______,该实验加热方式为____________。
(4)分析所制得的碱式碳酸铜的质量分数。
将已准确称量的0.5g试样样品放入300mL的锥形瓶中,加入5mL醋酸,适热使其溶解,再用l00mL水将其稀释。加入2.5gKI振荡混合,经过5分钟后,加入数滴淀粉溶液,用0.1mol/L的硫代硫酸钠溶液进行滴定。当_______时即达滴定的终点。
反应的原理:2Cu2++4I- =2CuI+I2, I2+2S2O32-=2I-+S4O62-
用0.lmol/L硫代硫酸钠40 mL,那么试样中铜的质量百分率为________。
该溶液的滴定度为_______。(毎毫升标准溶液相当于被测物质的质量,单位是g/mL或mg/mL)(保留三位有效数字)。
【答案】⑴2CuSO4+2Na2CO3+H2O=Cu(OH)2CO3+CO2
⑵①2.4 ②1.2
⑶温度过高,生成的碱式碳酸铜会加热分解 水浴加热
⑷ 滴入最后一滴硫代硫酸钠溶液,溶液恰好由蓝色变为无色,且半分钟不恢复蓝色 51.2% 0.0111g/mL
【解析】本题考查探究实验方案的设计与评价,涉及反应原理、反应原料用量比对反应产物的影响、反应温度对产率的影响和利用氧化还原滴定法测定碱式碳酸铜的质量分数等,根据题给信息结合基础知识解答。
(1)根据题给信息,碳酸钠和硫酸铜溶液混合加热生成碱式碳酸铜,且有气体生成,该气体为CO2,则反应的化学方程式为2CuSO4+2Na2CO3+H2O=Cu(OH)2CO3+CO2 。
(2)①根据表格提供的信息,碳酸钠溶液的体积依次递增4mL,所以表格中的空白处应该填2.4、1.2。
②根据题图可知,③处碱式碳酸铜的产量最高,即当比值为1.2时,碱式碳酸铜产量最好。
(3)根据上述实验现象可知,温度过高,生成的碱式碳酸铜会加热分解 ,所以温度过髙产率反而下降;该实验需要的温度为室温、30℃、50℃、100℃,则该实验加热方式为水浴加热。
(4)根据反应原理:2Cu2++4I- =2CuI+I2、I2+2S2O32-=2I-+S4O62-,得关系式Cu—S2O32-,所以n(Cu)=n(Na2S2O3)=0.1mol/L×0.04L=0.004mol,试样中铜的质量百分率为0.004mol×64g/mol÷0.5g×100%=51.2%。该溶液的滴定度为0.002mol×222g/mol÷40=0.0111g/mL。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A. 直线形;三角锥形
B. V形;三角锥形
C. 直线形;平面三角形
D. V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 煤焦油干馏可得到苯、甲苯等
B. 煤裂化可得到汽油、柴油、煤油等轻质油
C. 石油分馏可得到乙烯、丙烯等重要化工产品
D. 油脂皂化反应基本完成的现象是,反应后静置,反应液不分层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,对其进行开发利用的部分流程如下图所示。下列说法不正确的是

A.可用BaCl2溶液除去粗盐中的SO42-
B.从苦卤中提取Br2的反应的离子方程式为:2Br- + Cl2 == 2Cl- + Br2
C.试剂1可以选用石灰乳
D.工业上,电解熔融Mg(OH)2冶炼金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁在工业、医疗等领域均有重要用途。某化学小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了回收其中镁的工艺流程:
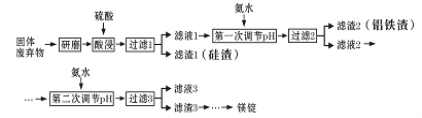
(1)酸浸前,将固体废弃物研磨的目的是_______,为达到此目的,还可以采取的措施是_____(任写一条)。
(2)酸浸时,生成滤渣I的离子方程式为_________。
(3)第一次调节pH的目的是_____。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为 _________ 。已知Ksp[Fe(OH)3 ]=4×10-38,Ksp[Al(OH)3 ]=1×10-33.
(4)设计简单方案分离滤渣2,简述实验过程:______。
(5)滤液3中可回收利用的物质主要是_____(填化学式),其阳离子的电子式为 _______。
(6)写出工业上从滤渣3中获得镁锭的所有反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一个燃料电池的示意图,当此燃料电池工作时,下列分析中正确的是

A.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则通H2的电极上发生的反应为:H2-2e-=2H+
B.如果a极通入H2,b极通入O2,H2SO4溶液作电解质溶液,则通 O2的电极上发生的反应为:O2+4e-+2H2O=4OH-
C.如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则通CH4的电极上发生的 反应为:CH4-8e-+10OH-=CO32-+7H2O
D.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则溶液中的OH-离子向b极附近移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应A2 + B2 ![]() 2AB △H= Q kJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是
2AB △H= Q kJ/mol的反应时间与生成物AB的质量分数(AB%)的关系如图所示,其中a、b为不同温度时的反应曲线(其他条件不变),c为在t3时刻开始缩小容器容积(温度不变)的变化曲线。下列有关说法正确的是

A. Q >0
B. A2、B2中最少有一种是气态物质
C. b对应的平衡状态时化学反应速率比c对应的平衡状态时化学反应速率大
D. AB一定是气体物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是
![]()
A. 相对分子质量M>N,沸点M>N B. 简单离子半径:D>B>C>A
C. Z为Na2CO3 D. 图中有两个氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com