
(15分)电石是重要的工业原料,电石渣[主要成分Ca(OH)2]的综合利用体现了绿色化学思想。
(1)用电石为原料可生产聚氯乙烯。聚氯乙烯的结构简式为____________。
(2)电石渣可用于除去垃圾焚烧炉烟道气中的SO2生成CaSO4,反应中的氧化剂是____________(填名称)。
(3)电石渣可用于生产纯碱。涉及的部分化学反应为:
(i)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(ii)2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
此生产过程中,可循环利用的物质有____________(填化学式)。
(4)用电石渣处理酸性含铬(Cr2O72—)电镀废水的流程如下:

①步骤(i)发生反应的化学方程式为__________________
②步骤(ii)发生反应的离子方程式为__________________
③步骤(iii)调节溶液pH为8,则残留Cr3+的浓度为___(Ksp[Cr(OH)3]=6.3×10—31)。
24(15分)(1)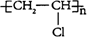 (2分)(2)氧气(2分)(3)NH3、CO2、H2O(3分)
(2分)(2)氧气(2分)(3)NH3、CO2、H2O(3分)
(4)①2SO2+Na2CO3+H2O=2NaHSO3+CO2(3分) ②3HSO3—+Cr2O72—+5H+=3SO42—+2Cr3++4H2O(3分)
③6.3×10—13molL(漏写单位扣1分,共2分)
【解析】
试题分析:(1)聚氯乙烯的结构简式为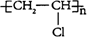
(2)电石渣的主要成分是氢氧化钙、碳酸钙等,SO2被吸收后变为亚硫酸钙,然后被空气中的氧气氧化为硫酸钙,所以氧化剂为氧气;(3)碳酸钙热分解生成CaO、CO2,CaO与水反应生成Ca(OH)2,共四步反应中,NH3、CO2、H2O可以循环利用;(4)①亚硫酸的酸性比碳酸强,则吸气步骤反应式为2SO2+Na2CO3+H2O=2NaHSO3+CO2;②根据电荷守恒、原子守恒可知,还原步骤反应式为3HSO3—+Cr2O72—+5H+=3SO42—+2Cr3++4H2O;③常温下pH=8,则c(OH—)=Kw/c(H+)=10—6mol/L,Cr(OH)3(s) Cr3+(aq)+3OH—(aq),Ksp[Cr(OH)3]=c(Cr3+)?c3(OH—)=6.3×10—31,则c(Cr3+)=6.3×10—13mol/L。
Cr3+(aq)+3OH—(aq),Ksp[Cr(OH)3]=c(Cr3+)?c3(OH—)=6.3×10—31,则c(Cr3+)=6.3×10—13mol/L。
考点:考查结构简式的书写、氧化剂、绿色化学理念、化学方程式、离子方程式、溶度积的计算等知识。


科目:高中化学 来源:2015届福建省高二上学期第二次月考化学试卷(解析版) 题型:选择题
下列叙述中,不能用勒夏特列原理解释的是 ( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:推断题
(12分)甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。

请回答下列问题:
(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为___________________________________________________。
(3)电解E的水溶液时,E起到的作用是_______________________________。
(4)写出B+C―→D的化学方程式:__________________________________;
写出E+G―→F的离子方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列关于物质结构和化学用语的说法正确的是
A.NH3的空间构型为三角锥形
B.1个二氧化碳分子中存在2个共用电子对
C.NaOH和Na2O中所含的化学键类型完全相同
D. PCl5和BF3分子中所有原子的最外层都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列物质的电离方程式不正确的是
A.NaHCO3===Na++H++
B.
C.AlCl3===Al3++3Cl-
D.NaHSO4===Na++H++
查看答案和解析>>
科目:高中化学 来源:2015届福建省福州市高三上学期第三次质检理综化学试卷(解析版) 题型:选择题
下列操作不能达到目的的是
选项 | 目的 | 操作 |
A. | 配制100 mL 1.0 mol/L CuSO4溶液 | 将25 g CuSO4·5H20溶于100 mL蒸馏水中 |
B. | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
C. | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
D. | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:实验题
(13分) 氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程:

根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为______________________________________。
(2)混合①中使用冰水的目的是___________ ______________________。
(3)操作Ⅱ和Ⅲ的名称分别是________、__________。操作Ⅲ一般适用于分离_______混合物(选填编号)。
a.固体和液体 b.固体和固体
c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是____________________________________________。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)常带有淡淡的黄色。 于是甲、乙两同学设计了简单实验加以探究:甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为____________,若假设成立可观察到的现象为____________________________。乙同学假设工业氢溴酸呈淡黄色是因为_____________________________,其用于证明该假设所用的试剂为______________。
查看答案和解析>>
科目:高中化学 来源:2015届福建省高三上学期第一次阶段考试化学试卷(解析版) 题型:选择题
某溶液中Cl-、Br-、I-三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完全后,该比值变为3:2:1,则反应的Cl2和原溶液中I-的物质的量之比是( )
A.1:2 B.1:3 C.1:4 D.1:6
查看答案和解析>>
科目:高中化学 来源:2015届福建省、安溪第一中学高三9月摸底考试化学试卷(解析版) 题型:选择题
一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150 mL 4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A.0.21 mol B.0.25 mol C.0.3 mol D.0.35 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com