
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述正确的是( )
4NO+6H2O(g),下列叙述正确的是( )
A.达到平衡状态,2 v正(NH3)= 3v逆(H2O)
B.反应达到平衡时,反应物的转化率一定小于100%
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】一种气态烷烃X和一种气态烯烃Y组成的混合物10g,其密度为相同条件下氢气密度的12.5倍,该混合气体通过溴水,使溴水增重8.4g,则X,Y可能是( )
A. 甲烷和丙烯B. 甲烷和乙烯C. 乙烷和乙烯D. 乙烯和丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把VL含有MgSO4、K2SO4的混合溶液分为两等份,一份加入amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含有bmolBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,则原混合溶液中钾离子的浓度为( )
A.![]() mol/LB.
mol/LB.![]() mol/LC.
mol/LC.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)___gH2O2中所含原子数与0.2molH3PO4所含原子数相等。
(2)同温同压下某容器中分别充满了O2、CO2及某气体X时的质量分别是116g、122g、114g,则气体X的相对分子质量是___。
(3)14.2g无水硫酸钠配制成500毫升溶液,其物质的量浓度为___;若从中取出50毫升溶液,其物质的量浓度为___,若将这50毫升溶液用水稀释到100毫升所得溶液中Na+的物质的量浓度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述不正确的是( )
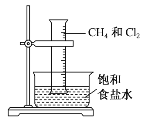
A.该反应的生成物只有四种
B.该反应的条件是光照
C.该反应属于取代反应
D.该反应现象有量筒内气体颜色变浅,器壁上有油状液滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)青奥会将于2014年8月在南京举行。青奥会建筑设施使用了大量节能材料,体现了“绿色青奥”的理念。
①用于青奥村工程的隔热保温材料聚氨酯属于______(填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
②青奥中心外墙的复合保温材料采用铝合金锁边。有关铝合金的性质正确的是___(填字母)。
a.强度小 b.耐腐蚀 c.密度大
③青奥会议中心双塔采用了玻璃幕墙设计。制造玻璃的主要原料为纯碱、石灰石和___(填字母)。
a.金刚砂 b.石英 c.水玻璃
(2)如图为某品牌酱油标签的一部分。

①氨基酸态氮的含量是酱油质量的重要指标,这些氨基酸是由大豆中的主要营养物质_____水解而来的。
②配料清单中属于防腐剂的是______。
③小麦中的主要营养物质是_____,写出这种物质完全水解的化学方式:______。
(3)A、B、C三个城市全年雨水的月平均pH变化如图所示。
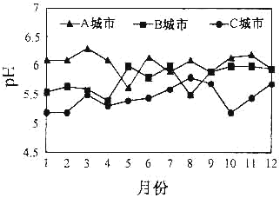
①受酸雨危害最严重的是____城市。
②导致硫酸型酸雨形成主要气体是___,减少燃煤过程产生该气体的措施有_________。
③汽车尾气中含有NO2、NO、CO等有害气体。写出由NO2形成硝酸型酸雨的化学方程式:______;汽车安装尾气净化装置可将NO、CO转化为无害气体,写出该反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某常见非金属黑色固体单质A,发生如下图所示的反应(生成物中水省略):

已知:X、Y的浓溶液均是无色液体,但Y的浓溶液久置会变成黄色;B、C是无色气体,D是红棕色气体,且C、D是形成酸雨的主要成分。请填写下列空白
(1)写出X、D两种物质的化学式:X________,D________。
(2)区别C和D两种气体的最简单的方法是_____________________________。
(3)写出②的化学方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | W | Y | |
X | 硫 | Z |
回答下列问题:
(1)表中元素原子半径最大的是___(写元素符号),Z原子核外电子能量最高的电子亚层是____。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是_____。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)W的氢化物与F2反应,生成一种铵盐与化合物WF3,WF3的分子构型为三角锥形。
①WF3分子为___〔填“极性”或“非极性”)分子。
②写出该反应的化学方程式,配平并标出电子转移的方向和数目:_____。
(4)硫酸工业生产中接触室内发生的反应方程式为_______;在实际生产中,操作温度选定400~500℃、压强通常采用常压的原因分别是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一个小烧杯中加入20g Ba(OH)2·8H2O晶体和10gNH4Cl晶体,然后将小烧杯放在事先滴有3滴~4滴水的玻璃片上,立即用玻璃棒搅拌。实验过程的示意图如下:
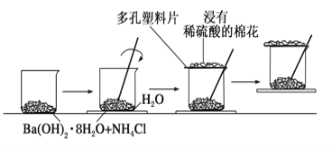
①实验中玻璃棒的作用是:_________。
②浸有稀硫酸的棉花的作用是:_________。
③出现_________现象时,说明该反应为吸热反应。
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生沼气,其主要成分是甲烷,可用来点火做饭。在农村推广建造沼气池,不仅能有效地利用_______能,还能为农业生产提供优良的肥料。已知:标准状况下112.0L CH4气体完全燃烧生成CO2和液态水时,放出4448kJ的热量。
①写出CH4完全燃烧的热化学方程式为:_________。
②如果上述反应生成的是水蒸气,则反应放出的热量:______4448kJ。(填“>”或“<”或“=”)
(3)钢铁在发生电化学腐蚀时钢铁中少量的碳作为原电池的______极,正极发生的电极反应式为:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com