
【题目】下列叙述不正确的是

A.图1所示,若将开关与a连接,可以实现化学能转化为电能;若将开关与b连接,相当于“外加电流的阴极保护法”
B.冰醋酸加水稀释过程中,溶液的导电能力随着水的体积变化的曲线如图2所示。a、b、c中导电能力最大的是b点,但b点对应醋酸的电离度并非最大
C.图3是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
D.图4为CO(g) + 2H2(g) ![]() CH3OH(g)的能量变化图,由此可知,生成1mol CH3OH(g),至少需要外界提供419kJ 的能量
CH3OH(g)的能量变化图,由此可知,生成1mol CH3OH(g),至少需要外界提供419kJ 的能量
【答案】D
【解析】
A. 图1所示,若将开关与a连接,则形成原电池,可以实现化学能转化为电能;若将开关与b连接,则形成电解池,铁连接负极,相当于“外加电流的阴极保护法”,选项A正确;
B.溶液离子浓度越大导电能力越强,加水促进醋酸的电离,故冰醋酸加水稀释过程中,溶液的导电能力随着水的体积变化的曲线如图2所示。a、b、c中导电能力最大的是b点,但b点对应醋酸的电离度并非最大,选项B正确;
C. 根据图中信息可知,随反应的进行,H2O2分解速率逐渐减小,选项C正确;
D. 图4为CO(g) + 2H2(g) ![]() CH3OH(g)的能量变化图,由此可知,生成1mol CH3OH(g),放出(510-419)kJ=91 kJ 的热量,选项D不正确;
CH3OH(g)的能量变化图,由此可知,生成1mol CH3OH(g),放出(510-419)kJ=91 kJ 的热量,选项D不正确;
答案选D。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】研究氮氧化物反应机理,对于控制汽车尾气、保护环境有重要意义。
(1)NO在空气中存在如下反应:2NO(g) + O2(g) ![]() 2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g)
2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g) ![]() N2O2(g)ΔH1<0,② ___________;
N2O2(g)ΔH1<0,② ___________;
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为: 4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。
5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。

①在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小(催化剂均末失效),写出300℃之后脱氮率减小的原因是_________。
②其他条件相同时,请在图中补充在催化剂B作用下脱氮率随温度变化的曲线________。

(3)工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,现有平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,则:
①x的取值范围为_________________。
②反应后溶液中n(NO2-)︰n(NO3-)=____________________。(用含x的代数式表示)
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25°C时有关弱酸的电离平衡常数如下表:
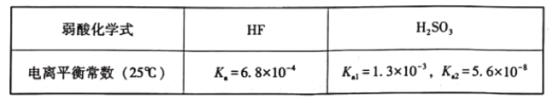
下列有关说法正确的是( )
A.等物质的量浓度的各溶液pH关系:pH(Na2SO3)<pH(NaF)<pH(NaHSO3)
B.将0.lmo/L的HF与0.1mol/L的NaF等体积混合,混合液pH>7
C.Na2SO3溶液中加入足量HF发生反应的离子方程式为SO32-+HF=F-+HSO3-
D.NaHSO3溶液中部分微粒浓度的大小:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温恒容密闭容器中存在反应:X(g)+2Y(g) ![]() Z(g) ΔH=-a kJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
Z(g) ΔH=-a kJmol-1(a>0),现向该容器中充入等物质的量的X(g)与Y(g)充分反应。下列说法正确的是
A.体系中混合气体的平均摩尔质量保持不变时,说明该反应达到化学平衡状态
B.达到平衡时,反应放出的热量一定小于a kJ
C.达到平衡时,X与Y的物质的量之比仍为1∶1
D.达到平衡后,若升高体系温度,则逆反应速率增加、正反应速率减少,平衡逆移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=- lgKa, 25°C时,弱酸H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1 mo/L NaOH溶液滴定20 mL 0.1 mol/L H2A溶液的曲线如下图所示。
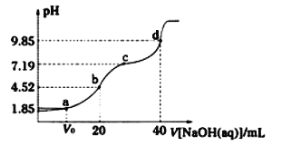
下列说法不正确的是
A.d点所得溶液中溶质的水解平衡常数Kh1=10-7.19
B.c点所得溶液中:c(Na+)+c(H+)= 2c(A2-)+ c(HA-)+ c(OH-)
C.b点所得溶液中: c(A2-)>c(H2A)
D.a点所得溶液中:溶质是NaHA和H2A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
实验流程如下:
C6H12O6溶液![]()
![]()
![]() 滤液
滤液![]() 悬浊液
悬浊液![]()
![]()
![]() Ca(C6H11O7)2
Ca(C6H11O7)2
已知:葡萄糖酸钙微溶于乙醇,可溶于冷水,易溶于热水。则下列说法不正确的是
A.第②步充分反应后CaCO3固体需有剩余,其目的是确保葡萄糖酸完全转化为钙盐
B.第④步加入乙醇的作用是减小葡萄糖酸钙在水中的溶解量,使其结晶析出
C.第⑤步过滤时,发现有固体产品残留在原容器壁上,可加少量热水冲洗再转移至过滤器内
D.可用O2代替Br2,在葡萄糖氧化酶作用下氧化葡萄糖进而制备葡萄糖酸钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟从I2-CCl4中提取碘并回收CCl4,查阅资料得到如下信息:
I2 | 紫黑色晶体,沸点184.3°C,易升华,升华后易凝华。在水中的溶解度很小,易溶于许多有机溶剂中 |
CCl4 | 无色有毒液体,沸点76.8℃,易挥发,与水互不相溶,可与乙醇、乙醚、氯仿及石油醚等混溶,不可燃烧,常作有机溶剂。 |
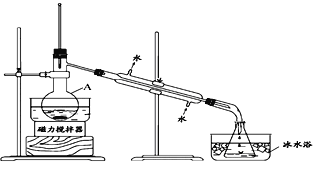
I.兴趣小组根据表中信息并结合已学知识,按上图组装仪器进行实验:
(1)该装置中仪器A的名称是____________。
(2)锥形瓶置于冰水中的目的是_____________。
(3)实验结果发现得到的CCl4呈浅紫红色。为进一步提纯CCl4,拟采用除杂分液的方法进行提纯,则下列操作次序正确的是:_______________________________。
①静置,待液体分层后,分液 ②加入稍过量的Na2SO3溶液 ③充分振荡,放气 ④将待分离溶液转移到分液漏斗中 ⑤对分液漏斗进行检漏
II.由于方法I没有达到预期目标,兴趣小组又设定如下方案进行实验:
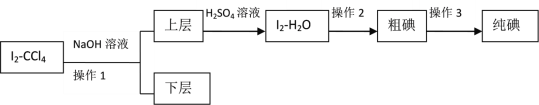
已知:3I2+6NaOH=5NaI+NaIO3+3H2O
(4)操作2的名称是____________。
(5)滴加少量硫酸时,溶液颜色变黄,试写出相应的离子方程式:________________。
(6)该实验中必须要控制NaOH溶液的浓度较_______(填“高”或“低”)和体积较_______(填“大”或“小”),理由是:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-—选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_________,3d能级上的未成对的电子数为______。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_____。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的成键原子是_____。
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是______;氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为_______。
(3)单质铜及镍都是由______键形成的晶体:元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______。
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com