
【题目】已知:pKa=- lgKa, 25°C时,弱酸H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1 mo/L NaOH溶液滴定20 mL 0.1 mol/L H2A溶液的曲线如下图所示。
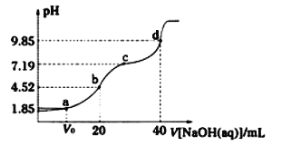
下列说法不正确的是
A.d点所得溶液中溶质的水解平衡常数Kh1=10-7.19
B.c点所得溶液中:c(Na+)+c(H+)= 2c(A2-)+ c(HA-)+ c(OH-)
C.b点所得溶液中: c(A2-)>c(H2A)
D.a点所得溶液中:溶质是NaHA和H2A
【答案】A
【解析】
A.弱酸H2A的pKa1=1.85,pKa2=7.19,则Ka1=10-1.85,Ka2=10-7.19,d点为加入NaOH溶液40mL,此时溶液中恰好生成Na2A,为第二个滴定终点,此时Na2A水解使溶液显碱性,溶液的pH为9.85,发生水解的方程式为A2+H2OHA+OH,则A2-水解平衡常数Khl=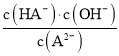 =
=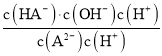 =
=![]() =
=![]() =106.81,故A错误;
=106.81,故A错误;
B.b点为加入NaOH溶液20mL,此时溶液中恰好生成NaHA,d点为加入NaOH溶液40mL,此时溶液中恰好生成Na2A,则c点所得溶液是NaHA和Na2A的混合溶液,该溶液中存在电荷守恒:c(Na+)+c(H+)= 2c(A2-)+ c(HA-)+ c(OH-),故B正确;
C.b点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHA,为第一个滴定终点,溶液中存在质子守恒:c(H2A)+c(H+)=c(A2)+c(OH),该点溶液的pH=4.52,显酸性,c(H+)>c(OH),则c(A2-)>c(H2A),故C正确;
D.a点时,加入氢氧化钠的体积小于20mL,弱酸H2A过量,所得溶液中:溶质是NaHA和H2A,故D正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】如图所示:若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是

A. 浓H2SO4B. NaOH溶液C. NaCl溶液D. Ca(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以镁渣[含有MgCO3、Mg(OH)2、CaCO3、Al2O3、Fe2O3和SiO2]为原料制取六水合氯化镁(MgCl2·6H2O),具体的工艺流程如图:

已知:①滤液2与适量石灰乳反应合成碱式氯化镁[Mg(OH)2-xClx·mH2O],当x=1,m=0时,碱式氯化镁为Mg(OH)Cl。
②相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下表:
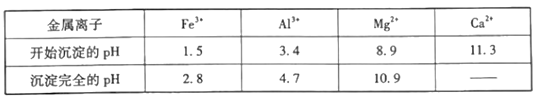
请回答下列问题:
(1)实验室煅烧样品的实验仪器为__。
(2)滤渣2的主要成分是__。
(3)通过调节滤液2的pH来获取Mg(OH)2沉淀,则溶液pH的范围为___。
(4)向溶液A中先加入___(填化学式)酸化,然后___、冷却结晶、过滤、洗涤和低温干燥得到MgCl2·6H2O,取少量低温干燥得到的MgCl2·6H2O晶体溶于水后发现溶液呈碱性,则含有的杂质是__从操作上分析引入杂质的原因是__。
(5)热重分析法是程序控制温度下测最物质的质量与温度关系的一种实验技术。MgCl2·6H2O的热重曲线如图。已知:MgCl2·6H2O在空气中受热脱水时,不产生无水氯化镁。

①试确定200℃时固态物质的化学式:___。
②温度升至554℃时分解得到的主要产物为白色固体和一种酸性气体,写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制480mL 0.1 mol/L的Na2CO3溶液,填空并回答下列问题:
(1)配制480mL 0.1 mol/L的Na2CO3溶液。
实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
____________ | ____________ |
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)____________。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1 cm~2 cm处
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
转移溶液后,未洗涤烧杯和玻璃棒就直接定容________;若定容时俯视刻度线__________。
(4)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,X是主要物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的组合是 ( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cu | Fe | NaOH溶液 | BaCl2溶液 |
A. A B. B C. C D. D
【答案】C
【解析】A.铜粉与氯化铁反应生成氯化亚铁和氯化铜,会引入新杂质,故A错误;B.二者均与Fe反应,不符合除杂的原则,不能除杂,故B错误;C.Al与NaOH溶液反应,而Fe不能,则加NaOH溶解后过滤可除杂,故C正确;D.二者均与BaCl2溶液反应,应加适量硫酸除杂,故D错误;故选C。
【题型】单选题
【结束】
19
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
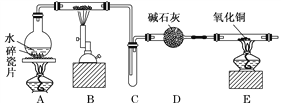
(1)A装置的作用是________________,B中反应的化学方程式为_____________。
(2)D的作用是____________________________________________________________。
(3)E中的现象是__________________________________________________________。
(4)A、B两个装置中应先点燃_______处的酒精灯,点燃E处酒精灯之前应进行的操作是_______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是

A.图1所示,若将开关与a连接,可以实现化学能转化为电能;若将开关与b连接,相当于“外加电流的阴极保护法”
B.冰醋酸加水稀释过程中,溶液的导电能力随着水的体积变化的曲线如图2所示。a、b、c中导电能力最大的是b点,但b点对应醋酸的电离度并非最大
C.图3是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
D.图4为CO(g) + 2H2(g) ![]() CH3OH(g)的能量变化图,由此可知,生成1mol CH3OH(g),至少需要外界提供419kJ 的能量
CH3OH(g)的能量变化图,由此可知,生成1mol CH3OH(g),至少需要外界提供419kJ 的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示的是纯净物、单质、化合物、含氧化合物、氧化物、碱之间的包含、不包含关系,若整个大圆圈代表纯净物,则下列选项中,能正确指出①、②、③、④、⑤所属物质类别的是( )
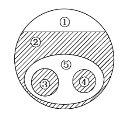
A. ①单质、③化合物
B. ②碱、⑤氧化物
C. ④碱、⑤含氧化合物
D. ④含氧化合物、③氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D. CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是我国古代的四大发明之一。黑火药爆炸时发生的反应为:2KNO3+S+3C=K2S+N2↑+3CO2↑。回答下列问题:
(1)基态钾原子的核外电子排布式为____________,第一电离能:K______ (填“>”或“<”)Na。
(2)NO3-的空间构型为_____________。
(3)固态硫易溶于CS2,熔点为112℃,沸点为444.8℃。其分子结构为 ,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
,S8中硫原子的杂化轨道类型是____________,S8分子中至多有________个硫原子处于同一平面。
(4)N2分子中σ键与π键的个数比为________,N2的沸点比CO的沸点____(填“高”或“低”)。
(5)K2S的晶胞结构如图所示。其中K+的配位数为_______,S2-的配位数为____;若晶胞中距离最近的两个S2-核间距为a cm,则K2S晶体的密度为____g·cm-3(列出计算式,不必计算出结果)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com