
[15分]甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
反应过程 | 化学方程式 | 焓变△H (kJ/mol) | 活化能Ea (kJ/mol) |
甲烷氧化 | CH4(g)+2O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸汽重整 | CH4(g)+H2O(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g) CO2(g)+H2(g)的△H= kJ/mol。
CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g) CO(g)+3H2(g)的KP= ;
CO(g)+3H2(g)的KP= ;
随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于 。
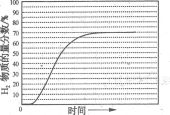
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:

①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9MpaB.700℃,0.9MPaC.800℃,1.5MpaD.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始即时)
的变化趋势示意图:

(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
(15分)
(1)-41.2
(2)小于
(3)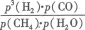
增大
(4)系统内强放热的甲烷氧化反应为强吸热的蒸汽重整反应提供了所需的能量(其他合理答案均可)
(5)①B
②
(6)甲烷氧化程度过高,氢气和氧气反应(其他合理答案均可)
【解析】(1)由反应CH4(g)+H2O(g) CO(g)+3H2(g) △H1=206.2 kJ/mol和CH4(g)+2H2O(g)
CO(g)+3H2(g) △H1=206.2 kJ/mol和CH4(g)+2H2O(g) CO2(g)+4H2(g) △H2=165.0 kJ/mol,再根据盖斯定律可知,反应CO(g)+H2O(g)
CO2(g)+4H2(g) △H2=165.0 kJ/mol,再根据盖斯定律可知,反应CO(g)+H2O(g) CO2(g)+H2(g)的△H=△H2-△H1=-41.2 kJ/mol;(2)开始时由于体系不能提供重整所需的热能,所以其氧化速率大于重整速率;(3)反应CH4(g)+H2O(g)
CO2(g)+H2(g)的△H=△H2-△H1=-41.2 kJ/mol;(2)开始时由于体系不能提供重整所需的热能,所以其氧化速率大于重整速率;(3)反应CH4(g)+H2O(g) CO(g)+3H2(g)的KP=
CO(g)+3H2(g)的KP=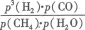 ;由于该反应为吸热反应,所以,当温度升高时其平衡常数将增大;(4)该方法的先进之处为,用甲烷氧化反应所释放出来的大量热量来满足强吸热的蒸汽重整反应所需要的热量;(5)①分析图表,从左图中可找到0.9 Mpa,700℃时H2的物质的量分数大于65%,从右图中可找到0.9 Mpa,700℃时CO的物质的量分数小于10%,所以B项正确;②图像特点为开始由于体系温度未达到400℃,重整反应微弱,H2的含量几乎为0,后随着反应进行,体系的温度升高H2的含量也增大,到接近70%时达到最大值;(6)若甲烷氧化程度过高,若氧气的含量再增加,这时氢气将和氧气反应,导致氢气的物质的量分数下降。
;由于该反应为吸热反应,所以,当温度升高时其平衡常数将增大;(4)该方法的先进之处为,用甲烷氧化反应所释放出来的大量热量来满足强吸热的蒸汽重整反应所需要的热量;(5)①分析图表,从左图中可找到0.9 Mpa,700℃时H2的物质的量分数大于65%,从右图中可找到0.9 Mpa,700℃时CO的物质的量分数小于10%,所以B项正确;②图像特点为开始由于体系温度未达到400℃,重整反应微弱,H2的含量几乎为0,后随着反应进行,体系的温度升高H2的含量也增大,到接近70%时达到最大值;(6)若甲烷氧化程度过高,若氧气的含量再增加,这时氢气将和氧气反应,导致氢气的物质的量分数下降。
【考点定位】本题考查盖斯定律、化学平衡和图表分析能力。


科目:高中化学 来源:2013-2014上海市宝山区高二年级化学学科质量监测化学试卷(解析版) 题型:选择题
下列关于写图所示原电池的叙述中,正确的是
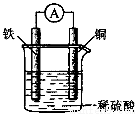
A.质量减轻的一极是铜极
B.负极反应为Fe—2e → Fe2+
C.该装置将电能转变为化学能
D.电流由负极经导线流向正极
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(重庆卷解析版) 题型:选择题
(6分)(2012?重庆)下列叙述正确的是( )
A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小
C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变
D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(海南卷解析版) 题型:选择题
下列叙述错误的是
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.铁管上镶嵌锌块,铁管不易被腐蚀
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(海南卷解析版) 题型:选择题
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是
A.HCl、CuCl2、Ba(OH)2 B.NaOH、CuSO4、H2SO4
C.NaOH、H2SO4、Ba(OH)2 D.NaBr、H2SO4、Ba(OH)2
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(浙江卷解析版) 题型:选择题
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
下列说法不正确的是

A.在阴极式,发生的电极反应为:2H2O+2e- 2OH―+H2↑
2OH―+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2 +2H+
+2H+
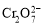 +H2O向右移动
+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O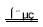 2K2Cr2O7+4KOH+2H2↑+2O2↑
2K2Cr2O7+4KOH+2H2↑+2O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α=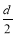
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(新课标解析版) 题型:实验题
(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
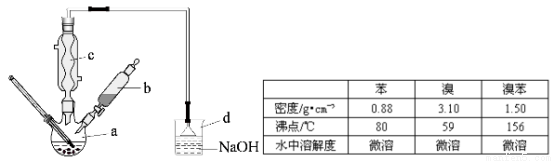
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 ③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。
A.25mL B. 50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(广东卷解析版) 题型:选择题
(4分)(2012?广东)设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温下,4g CH4含nA个C﹣H共价键
B.1 mol Fe与足量稀HNO3反应,转移个2nA个电子
C.1L 0.1 mol/L NaHCO3溶液中含有0.1nA个HCO3﹣
D.常温常压下,22.4L的NO2和CO2混合气体含有2nA个O原子
查看答案和解析>>
科目:高中化学 来源:2012-2014四川省宜昌市春季期中考试高一化学试卷(解析版) 题型:选择题
将氨基甲酸铵晶体置于特制的密闭真空容器中(假设容器体积不变,固体体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s) 2NH3(g)+ CO2(g)。不能说明该分解反应达到平衡状态的是 ( )
2NH3(g)+ CO2(g)。不能说明该分解反应达到平衡状态的是 ( )
A.单位时间内生成1 mol CO2的同时消耗2 mol NH3
B.形成6个N—H键的同时有2个C=O键断裂
C.容器中CO2与NH3的物质的量之比保持不变
D.混合气体的密度不再改变的状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com