
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的简化电子排布式为________。
(2)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含____molσ键,与CO互为等电子体的离子是_____(填化学式,写一种)。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3),钛酸亚铁与浓硫酸反应生成TiSO4,SO42—中S原子的杂化方式为____,用价层电子对互斥理论解释SO32—的键角比SO42—键角小的原因___________________________________________________。
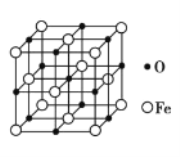
(4)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为____。

(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为____;Fe2+与O2—的最短核间距为____pm。
【答案】[Ar]3d5 10 CN-或C22- SP3杂化 SO32-中孤电子对对成键电子对的排斥比SO42-中的成键电子对间的排斥作用大 3:1 12 (36/ρ×NA)1/3×1010
【解析】
(1)基态Fe2+简化的电子排布式为[Ar]3d6;
(2)[Fe(CO)5]分子中CO分子含有一个σ键,每个CO分子与Fe原子之间有一个σ键,共10个σ键;根据等电子体的概念得出与CO互为等电子体的离子的化学式为CN-或C22-;
(3)根据SO42-的VSEPR模型为正四面体,没有孤电子对,S原子的杂化方式是sp3杂化;SO32-中孤对电子对对成键电子对的排斥作用比SO42-中成键电子对间的排斥作用大;
(4)用“均摊法”,晶胞中含铁:12×1/6+2×1/2+3=6个,含氮:2个,该晶体中铁、氮的微粒个数之比为=6:2=3:1;
(5)根据晶胞,Fe2+为面心立方,与Fe2+紧邻且等距离的Fe2+数目为12个;晶胞参数等于相邻两个离子核间距的2倍。
(1)基态Fe2+简化的电子排布式为[Ar]3d6,故答案为:[Ar]3d6。
(2)[Fe(CO)5]分子中CO分子含有一个σ键,每个CO分子与Fe原子之间有一个σ键,共10个σ键,所以1mol[Fe(CO)5]分子中含有10mol的σ键,与CO互为等电子体的离子的化学式为CN-或C22-,
故答案为:10,CN-或C22-。
(3)SO42-的VSEPR模型为正四面体,没有孤电子对,S原子的杂化方式是sp3,SO42-中S原子的杂化方式为sp3杂化;用价层电子对互斥理论解释SO32-的键角比SO42-键角小的原因:SO32-中孤对电子对对成键电子对的排斥作用比SO42-中成键电子对间的排斥作用大,
故答案为:sp3杂化;SO32-中孤电子对对成键电子对的排斥比SO42-中的成键电子对间的排斥作用大。
(4)氮化铁晶胞为六棱柱,顶点贡献率为1/6,棱点贡献率为1/3,面点贡献率为1/2,观察晶胞可知,12个铁位于顶点,2个铁位于面心,3个铁位于体内,2个N位于体内,用“均摊法”可知,1个晶胞中含铁微粒数:12×1/6+2×1/2+3=6个,含氮微粒数:2个,该晶体中铁、氮的微粒个数之比为=6:2=3:1,
故答案为:3:1。
(5)根据晶胞图可知,氧化亚铁晶胞类似氯化钠晶胞,棱上3个离子相切,晶胞参数等于相邻两个离子核间距的2倍。上、中、下三层各4个氧离子(共12个氧离子)与中心的氧离子紧邻且等距离,用“均摊法”,晶胞中含Fe2+:8×1/8+6×1/2=4个,含O2-:12×1/4+1=4个,晶胞的化学式为FeO,氧化亚铁中氧离子、亚铁离子个数比为1:1,所以,有12个Fe2+与Fe2+紧邻且等距离。1个氧化亚铁晶胞中含4个FeO,设Fe2+与O2-的最短核间距为dpm,1molFeO的质量为72g,氧化亚铁晶体的密度为ρgcm-3,则有ρ=m/V=72×4/NA(2d×10-10)3,解得d=(36/ρ×NA)1/3×1010pm,所以Fe2+与O2-的最短核间距为(36/ρ×NA)1/3×1010pm,故答案为:12;(36/ρ×NA)1/3×1010pm。


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 1molH2和1molI2在加热条件下充分反应,生成HI的分子数为2NA
B. 10g质量分数为46%的乙醇溶液含有的氢原子数目为0.6NA
C. 20mL0.1 mol/LAlCl3溶液中,水解形成Al(OH)3胶体粒子数为0.002NA
D. 0.1molNa2O2和Na2O的混合物中含有的离子总数等于0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. T的氢化物的沸点一定高于同主族元素形成的其他氢化物
D. T元素单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是重要的核工业原料。下列有关
是重要的核工业原料。下列有关![]() 、
、![]() 说法正确的是
说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 互为同素异形体
互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄钠铁钒渣主要含有Na2Fe6(SO4)4(OH)12、BaSO4、NiSO4、MgSO4、CaSO4、Al2(SO4)3等,利用其制备镍锌铁氧体工艺流程如下。

已知:①锌、铝两种元素化学性质相似;②晶体完整度与晶体中Ni、Zn、Fe比例有关;③常温下,相关物质的pKsp单如下表:
![]()
(1)“焙烧”中无烟煤的作用为___________.
(2)“调pH”时,a值可取___________(填标号)。
A.3.2 B.4.3 C.5.2 D.9.1
(3)若“净化”后的溶液中c(M2+)=1.0×10-3mol·L-1,则c(Ca2+)=___________ mol·L-1。
(4)“水热合成”发生反应的离子方程式为___________,滤液的主要成分为___________(填化学式)
(5)由右图可知,pH=8时“水热合成”所得镍锌铁氧体晶体的完整度最高,其原因是___________。
(6)“焙烧”会生成少量BaS,对该工艺造成的影响是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代劳动人民在生产生活中积累了丰富的经验,很多生产过程的操作方法与化学实验中的物质分离除杂方法相似。下列加有着重号的文字与对应分离方法正确的是( )
《本草集经注》 | 《通州煮海录》 | 《名医别录》 | 《续遵义府志》 |
凡渍药酒,皆须细切……便可漉出 | 海陆取卤,日晒火煎,煮海熬波,卤水成盐 | 凡煮汤,欲微火,令小沸……箅渣取液 | 经月画出蒸之……终乃得酒可饮 |
|
|
|
|
A.过滤、蒸馏、萃取、蒸发B.过滤、蒸发、萃取、蒸馏
C.蒸发、萃取、蒸馏、过滤D.萃取、蒸发、过滤、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
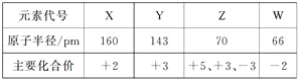
【题目】几种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是
A. X、Y 元素的金属性X<Y
B. 一定条件下,Z单质与W的常见单质直接生成ZW2
C. Y的最高价氧化物对应的水化物能溶于稀氨水
D. 一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。
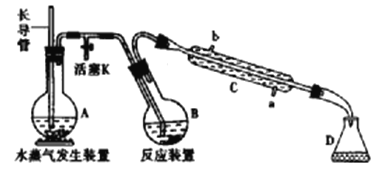
(1)A的名称是___________,长导管用于平衡压强,实验过程中其下端___________(填“能”或“不能”)在液面以上。
(2)仪器C是直形冷凝管,实验过程中,冷却水应从___________口出。(填“a”或“b")
(3)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏:若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即______________________。
(4)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是___________。
(5)B中加入一定体积高氯酸和1.00g氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。
①下列物质不可代替高氯酸的是___________(填标号)
a.醋酸 b.硝酸 c.磷酸 d.硫酸
②D中主要反应的离子方程式为_________________________________。
(6)向馏出液中加入25.00mL0.100mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用0.100 mol·L -1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1︰1络合),消耗EDTA标准溶液20.00mL,则氟化稀土样品中氟的质量分数为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com