
【题目】黄钠铁钒渣主要含有Na2Fe6(SO4)4(OH)12、BaSO4、NiSO4、MgSO4、CaSO4、Al2(SO4)3等,利用其制备镍锌铁氧体工艺流程如下。

已知:①锌、铝两种元素化学性质相似;②晶体完整度与晶体中Ni、Zn、Fe比例有关;③常温下,相关物质的pKsp单如下表:
![]()
(1)“焙烧”中无烟煤的作用为___________.
(2)“调pH”时,a值可取___________(填标号)。
A.3.2 B.4.3 C.5.2 D.9.1
(3)若“净化”后的溶液中c(M2+)=1.0×10-3mol·L-1,则c(Ca2+)=___________ mol·L-1。
(4)“水热合成”发生反应的离子方程式为___________,滤液的主要成分为___________(填化学式)
(5)由右图可知,pH=8时“水热合成”所得镍锌铁氧体晶体的完整度最高,其原因是___________。
(6)“焙烧”会生成少量BaS,对该工艺造成的影响是___________。
【答案】提供热量、还原剂 C 1.0×10-5mol·L-1 xZn2++(1-x)Ni2++2Fe2++6OH-+H2O2 ![]() Ni(1-x)ZnxFe2O4↓+4H2O Na2SO4 pH<8,沉淀不完全,pH>8,Zn(OH)2沉淀溶解 BaS与酸反应会生成H2S气体污染环境,生成NiS沉淀降低产率
Ni(1-x)ZnxFe2O4↓+4H2O Na2SO4 pH<8,沉淀不完全,pH>8,Zn(OH)2沉淀溶解 BaS与酸反应会生成H2S气体污染环境,生成NiS沉淀降低产率
【解析】
根据工艺流程图分析每步过程发生的反应及滤渣和溶液的成分;根据Ksp计算溶液的酸碱性,分析沉淀溶解是否完全。
(1)根据流程图中的反应原理,“焙烧”中无烟煤的作用为提供热量、还原剂,
故答案为:提供热量、还原剂;
(2)调pH主要是除去Mg2+和Al3+,但Fe3+不能沉淀,根据氢氧化铁的pKsp计算得:pKsp=-lg[c(Fe3+)c3(OH-)]=37.4,c(OH-)=![]() =10-9.4,则a=5.6,
=10-9.4,则a=5.6,
故答案为:C;
(3)根据MgF2和CaF2的pKsp计算得:由c(Mg2+)=1.0×10-3mol·L-1得,c(F-)=![]() =10-2.6mol·L-1,pKsp(CaF2)=-lg[c(Ca2+)c2(F-)]=10.2,则c(Ca2+)=1.0×10-5mol·L-1,
=10-2.6mol·L-1,pKsp(CaF2)=-lg[c(Ca2+)c2(F-)]=10.2,则c(Ca2+)=1.0×10-5mol·L-1,
故答案为:1.0×10-5mol·L-1;
(4)根据题干信息,水热合成发生反应的离子方程式为xZn2++(1-x)Ni2++2Fe2++6OH-+H2O2 ![]() Ni(1-x)ZnxFe2O4↓+4H2O,滤液的主要成分为Na2SO4,
Ni(1-x)ZnxFe2O4↓+4H2O,滤液的主要成分为Na2SO4,
故答案为:xZn2++(1-x)Ni2++2Fe2++6OH-+H2O2 ![]() Ni(1-x)ZnxFe2O4↓+4H2O;Na2SO4;
Ni(1-x)ZnxFe2O4↓+4H2O;Na2SO4;
(5)根据图示信息得:pH<8,沉淀不完全,pH>8,Zn(OH)2沉淀溶解,
故答案为:pH<8,沉淀不完全,pH>8,Zn(OH)2沉淀溶解;
(6)分析工艺流程知:BaS与酸反应会生成H2S气体污染环境,生成NiS沉淀降低产率,
故答案为:BaS与酸反应会生成H2S气体污染环境,生成NiS沉淀降低产率。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:
【题目】南欧紫荆是一种耐碱抗寒的绿化植物,其细胞液浓度很高,有利用根从周围土壤中吸收水分.该植物根细胞中含量最多的物质是( )
A. 蛋白质B. 脂质C. 水D. 无机盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置图及有关说法正确的是( )

A. 装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大
B. 装置①中K键闭合时,片刻后可观察到滤纸a点变红色
C. 装置②中铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>只闭合K2>都断开
D. 装置③中当铁制品上析出1.6![]() 铜时,电源负极输出的电子数为0.025NA
铜时,电源负极输出的电子数为0.025NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的简化电子排布式为________。
(2)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含____molσ键,与CO互为等电子体的离子是_____(填化学式,写一种)。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3),钛酸亚铁与浓硫酸反应生成TiSO4,SO42—中S原子的杂化方式为____,用价层电子对互斥理论解释SO32—的键角比SO42—键角小的原因___________________________________________________。
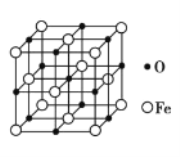
(4)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为____。

(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为____;Fe2+与O2—的最短核间距为____pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲用98%的浓H2SO4(ρ=1.84g/cm3)配制成500mL 0.5mol/L的稀H2SO4。
(1)填写下列操作步骤:
①所需浓H2SO4的体积为_____。
②如果实验室有10mL、20mL、50mL量筒,应选用____mL量筒量取。
③将量取的浓H2SO4沿玻璃棒慢慢注入盛有约100mL水的____里,并不断搅拌,目的是_____。
④立即将上述溶液沿玻璃棒注入_____中,并用50mL蒸馏水洗涤烧杯2~3次,并将洗涤液注入其中,并轻轻振荡摇匀。
⑤加水至距刻度____处,改用_____加水,使溶液的凹液面正好跟刻度相平。盖上瓶塞,上下颠倒数次,摇匀。
(2)请指出上述操作中一处明显错误:______。
(3)误差(填偏高、偏低、无影响)
操作②中量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将____;
若容量瓶中洗净后未干燥,残留少量水,则所配制的溶液浓度_____;
操作⑤中,若定容时,眼睛俯视,则所配制的溶液浓度______。
(4)若实验过程中出现加蒸馏水时不慎超过了刻度如何处理?______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol/L弱酸RCOOH溶液的pH,溶液中RCOOH分子的物质的量分数δ(RCOOH)随之改变[已知![]() ,甲酸(HCOOH)]与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是
,甲酸(HCOOH)]与丙酸(CH3CH2COOH)溶液中δ(RCOOH)与pH的关系如图所示。下列说法正确的是

A. 图中M、N两点对应溶液中的c(OH-)比较:前者>后者
B. 丙酸的电离常数K=10-4.88
C. 等浓度的HCOONa和CH3CH2COONa两种溶液的pH比较:前者>后者
D. 将0.1 mol/L的HCOOH溶液与0.1 mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于新冠肺炎疫情环境消毒用的“84消毒液”的主要成分是次氯酸钠(NaClO),按物质的组成和性质进行分类,次氯酸钠属于
A.氧化物B.酸C.碱D.盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钪(Sc)是一种典型的稀散元素,具有重要的工业利用价值,从钛尾矿( mSc2O3·nTiO2·xFeO·ySiO2)中提取Sc2O3的流程如下:

(1)“焙烧”时,为提高焙烧效率,下列措施中无效的是___________(填标号)
a.不断搅拌 b.进一步粉碎固体颗粒 c.增大压强 d.适当升高温度
(2)“酸浸”时,需在80℃条件下进行,则适宜的加热方式为______________________。
(3)“萃取”时,使用伯胺N1923的煤油溶液作为萃取液,萃取率α受振荡时间和萃取剂浓度的影响,椴据下表1和表2数据,萃取时适宜的振荡时间和萃取剂浓度分别为___________min、___________%。

(4)“酸洗”后滤液中存在的金属阳离子有Na+、Sc3+、Ti4+、Fe2+,且浓度均小于0.100mol·L-1,“反萃取”时,加氢氧化钠溶液调节溶液pH=__________时,可使Sc3+沉淀完全(当离子浓度减小至10-5 mol·L-1时,可认为沉淀完全),从滤渣Ⅲ中可以回收的金属元素名称为__________。(已知;lg2=0.3,1g5=0.7;室温下,Ti4+完全沉淀的pH为1.05,Ksp[Fe(OH)2]=4.0×10-17,Ksp[Sc(OH)3]=1.25×10-33)
(5)草酸钪[Sc2(C2O4)3]在空气中“灼烧”的化学方程式为______________________。
(6)若从1吨该钛尾矿中提取得到110.4gSc2O3,则该矿中含钪的质量分数为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com