
【题目】下列装置图及有关说法正确的是( )

A. 装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大
B. 装置①中K键闭合时,片刻后可观察到滤纸a点变红色
C. 装置②中铁腐蚀的速度由大到小的顺序是:只闭合K1>只闭合K3>只闭合K2>都断开
D. 装置③中当铁制品上析出1.6![]() 铜时,电源负极输出的电子数为0.025NA
铜时,电源负极输出的电子数为0.025NA
【答案】B
【解析】
A、原电池中阴离子向负极移动;
B、阴极氢离子放电同时生成氢氧根离子;
C、Fe作阳极被腐蚀,作阴极被保护;
D、根据电极方程式计算。
A、该装置电源为原电池,锌为负极,铜为正极,原电池中阴离子向负极移动,则Cl-向ZnSO4溶液移动,故A错误;
B、装置①中K键闭合时,a极为阴极,阴极氢离子放电同时生成氢氧根离子,所以a附近变红色,故B正确;
C、Fe作阳极被腐蚀,作阴极被保护,只闭合K1,铁作阳极被腐蚀;只闭合K2,铁作阴极被保护;只闭合K3,铁作负极被腐蚀;所以铁腐蚀的速度由大到小的顺序是: 只闭合K1>只闭合K3>都断开>只闭合K2,故C错误;
D、装置③中当铁制品的反应为Cu2++2e-=Cu,析出1.6g铜即0.025mol时,电源负极输出的电子数为0.05 NA ,故D错误;
综上所述,本题选B。


科目:高中化学 来源: 题型:
【题目】草酸是一种酸,草酸晶体(H2C2O42H2O)易溶于水,熔点较低,加热会熔化、气化和分解。草酸(H2C2O4)与氢氧化钙的反应:H2C2O4+Ca(OH)2=CaC2O4↓(白色)+2H2O。
(1)草酸的水溶液的pH___7(填“>”、“=”、“<”)
(2)实验室可用加热草酸晶体分解的方法获得CO。
①先加热草酸晶体生成CO、CO2和H2O,其化学方程式是____;
②最后用图1装置收集CO,气体应从___端进入(选填“a”或“b”)。
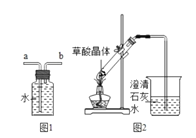
(3)实验图2中观察到澄清石灰水变浑浊,乙认为一定是由草酸晶体受热分解产生的CO2所导致,丙认为乙的结论不严密,理由是___。
按图3装置将草酸钙晶体(H2C2O4xH2O)样品高温加热,使其完全分解。

(4)B中观察到硫酸铜变蓝,说明反应生成了_____;
(5)C、G中澄清石灰水均变浑浊,说明反应还生成___和___气体。
(6)反应开始前通入氮气的目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素在自然界中都以典型的盐类存在,包括氟、氯、溴、碘和砹五种元素,位于元素周期表的第ⅦA族,其中氯、溴和碘主要来之海水。卤素元素在生产实际中承担着重要角色。请回答下列问题:
(1)将经过验纯的氢气点燃,伸入盛有氯气的集气瓶中,在集气瓶口可观察到的现象是_________。
(2)欲检验Na2CO3、Na2SO4、NaCl的混合溶液中的Cl-,正确的操作方法是_____________。
(3)海水晒盐所获取的粗盐,经过提纯、精制之后,其水溶液进行电解,可以得到重要的化工原料。请写出该电解反应的离子方程式______。海带中提取碘时,将海带烘干、灼烧目的是_____、_____。
(4)将0.01 molCl2通入含0.03 molNaBr和0.03 molKI的混合液中,发生反应的离子方程式为_____;再将所得溶液分为两等份,其中一份蒸干、灼烧,最后得到的固体的成分一定有KCl,还有___;另一份再加入少量CCl4,振荡,则CCl4层的颜色是____,分离CCl4层和水层的操作名称是__,需要使用的玻璃仪器除烧杯外,还有_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电渗析法可将含硝酸钠的废水再生为硝酸和氢氧化钠,其装置如图所示。

下列叙述不正确的是
A. 膜a、膜c分别是阴离子交换膜、阳离子交换膜
B. 阳极室、阴极室的产品分别是氢氧化钠、硝酸
C. 阳极的电极反应式为2H2O-4e-=4H++O2↑
D. 该装置工作时,电路中每转移0.2 mol 电子,两极共生成气体3.36L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2012·课标全国卷](9分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是____________________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是______________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为________,要进一步提纯,下列操作中必须的是________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填入正确选项前的字母)。
A.25 mL B.50 mL C.250 mL D.500 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄钠铁钒渣主要含有Na2Fe6(SO4)4(OH)12、BaSO4、NiSO4、MgSO4、CaSO4、Al2(SO4)3等,利用其制备镍锌铁氧体工艺流程如下。

已知:①锌、铝两种元素化学性质相似;②晶体完整度与晶体中Ni、Zn、Fe比例有关;③常温下,相关物质的pKsp单如下表:
![]()
(1)“焙烧”中无烟煤的作用为___________.
(2)“调pH”时,a值可取___________(填标号)。
A.3.2 B.4.3 C.5.2 D.9.1
(3)若“净化”后的溶液中c(M2+)=1.0×10-3mol·L-1,则c(Ca2+)=___________ mol·L-1。
(4)“水热合成”发生反应的离子方程式为___________,滤液的主要成分为___________(填化学式)
(5)由右图可知,pH=8时“水热合成”所得镍锌铁氧体晶体的完整度最高,其原因是___________。
(6)“焙烧”会生成少量BaS,对该工艺造成的影响是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,还可利用CO2据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。
(1)利用CO2和H2反应合成甲醇的原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)/% | 10 | 20 | 30 | 4b | 50 | 60 | 70 | 80 | 90 |
CH3OH的产率 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为________催化效果最佳。
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)
CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)

A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)①在1L的恒定密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示,则压强P2________P1(填“>”、“<”或“=”);平衡由A点移至C点、D点移至B点,分别可采取的具体措施为________、________;在c点时,CO的转化率为________。
②甲和乙两个恒容密闭容器的体积相同,向甲中加入1molCO和2molH2,向乙中加入2molCO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)________2P(L);平衡常数:K(M)________K(L)。(填“>”、“<”或“=”)

(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液480mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在如图所示仪器中,配制上述溶液肯定不需要的是________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是_________。

(2)在容量瓶的使用方法中,下列操作不正确的是________(填序号)
A.使用容量瓶前检验是否漏水
B.配制NaOH溶液时,把称好的NaOH固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm 处,用胶头滴管加蒸馏水至刻度线
C.配制H2SO4溶液时,容量瓶用蒸馏水洗净后,还要用0.5mol/LH2SO4溶液润洗,方可使用
D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(3)根据计算用托盘天平称取的质量为_______g。
(4)配制硫酸溶液过程中,下列操作会引起结果偏高的是________(填序号)
A.未洗涤烧杯、玻璃棒
B.未冷却至室温就转移到容量瓶定容
C.定容时仰视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com