
【题目】如图可设计成多种用途的电化学装置,下列说法错误的是

A. a与电源正极相连时,铜做阳极
B. a和b用导线连接时,锌做负极
C. a和b用导线连接时,铜片上发生的反应为:2H++2e -=H2↑
D. a与电源正极相连可以保护锌片,称为牺牲阳极的阴极保护法
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】如图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是( )

A. 1 mol H2中的化学键断裂时需要吸收436 kJ能量
B. 2 mol HCl分子中的化学键形成时要释放862 kJ能量
C. 此反应的热化学方程式为:H2(g)+Cl2(g)==2HCl(g)ΔH=+183 kJ/mol
D. 此反应的热化学方程式为:1/2H2(g)+1/2Cl2(g)==HCl(g)ΔH=-91.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属组成的合金25克与氯气完全反应,共用去标况下氯气11.2升,该合金的可能组成是
A.Na和MgB.Cu和CaC.Cu和ZnD.Fe和Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在人类的生活生产中有着重要的作用,Fe2+、Fe3+是影响水质的一个重要因素。回答下列问题:
I:测量某河水样本中铁的含量
(1)水样中Fe2+的含量越大,溶解氧的含量就越低,用离子方程式解释原因___________。
(2)测定Fe2+取5mL c mo/L的KMnO4标准液,稀释至100mL。取10.00mL河水水样,加入稀硫酸后,用稀释后的KMnO4溶液进行滴定,用去KMnO4溶液V1mL。
①用___________(填滴定管的名称)盛放KMnO4标准液。
②滴定达到终点的标志是___________。
(3)测定Fe3+:取10.00mL水样,转移至盛有过量锌粒的烧杯中充分反应。加入过量稀硫酸,用表面皿盖住烧杯并加热10分钟。冷却后用(2)中稀释后的KMnO4溶液滴定,消耗KMnO4溶液V2mL。
①锌粒的作用是___________。
②河水中Fe3+的浓度是___________mol/L(用含字母的代数式表示)。
Ⅱ:氢氧化亚铁[Fe(OH)2]在常温常压下为白色固体。
(4)当溶液中的离子浓度<1×10-5mol·L-1时,可以认为该离子已沉淀完全。已知常温Fe(OH)2的Ksp为8.0×10-16。现调节含Fe2+的某河水样品pH=9,用简要计算过程说明Fe2+是否已经达到沉淀完全:___________。
(5)一种用Na2SO4溶液做电解液,电解制取Fe(OH)2的实验装置如图所示。通电后,溶液中产生白色沉淀,且较长时间不变色。

①必须使用铁电极的是___________(填“A"或“B”)极。
②B电极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种溶液分别是氢氧化钡溶液、氨水、醋酸溶液、盐酸中的一种。
已知同浓度的四种溶液:①加入大小完全相同的镁条,仅A、C中放出气体,且开始时A中冒气泡的速度快;②相同条件下,取B、D溶液进行导电性实验,发现导电能力最差的是D。回答下列问题:
(1)D溶液为_______________;同浓度的四种溶液中,pH值最大的是______________(填化学式)溶液。
(2)pH值和体积均相同的A和C溶液,分别与足量大小完全相同的锌粒反应,开始时的反应速率
v(A)______________v(C) (填“>”“<”或“=”)
(3)等体积等浓度的氨水和盐酸混合后,所得溶液呈______________(填“酸性”、“碱性”或“中性”),用离子方程式解释其原因__________________________________。
(4)常温下,2mol/L的NaOH溶液与amol/L的醋酸溶液等体积混合后,发现溶液呈中性,
试计算:该温度下醋酸钠的水解平衡常数Kb=________________(用含a的代数式表示。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钠、氯化钠和氧化镁等离子晶体的核间距和晶格能(部分)如下表所示

(1)溴化钠晶体比氯化钠晶体晶格能________(填“大”或“小”),主要原因是_____。
(2)氧化镁晶体比氯化钠晶体晶格能大,主要原因是_________________________________。
(3)溴化钠、氯化钠和氧化镁晶体中,硬度最大的是________。工业制取单质镁时,往往电解的是氯化镁而不是氧化镁,主要原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在2 L密闭容器中进行,5s后,水蒸气的物质的量增加了6 mol,则此反应的平均速率可表示为( )
4NO(g)+6H2O(g)在2 L密闭容器中进行,5s后,水蒸气的物质的量增加了6 mol,则此反应的平均速率可表示为( )
A.ν(H2O)=0.6 mol/(L·s)B.ν(O2)=0.72 mol/(L·s)
C.ν(NO)==0.9 mol/(L·s)D.ν(NH3)=0.4 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗肿瘤药物中间体的合成路线如下。下列说法正确的是( )
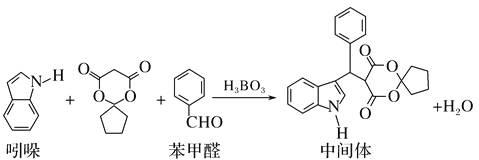
A. 吲哚的分子式为C8H6N
B. 苯甲醛中所有原子不可能全部共平面
C. 可用新制氢氧化铜悬浊液区分苯甲醛和中间体
D. 1mol该中间体,最多可以与9mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图装置实验,若x轴表示流入正极的电子的物质的量,则y轴应表示( )
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
A. ① ③ B. ③ ④ C. ① ② ④ D. ②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com