
【题目】两种金属组成的合金25克与氯气完全反应,共用去标况下氯气11.2升,该合金的可能组成是
A.Na和MgB.Cu和CaC.Cu和ZnD.Fe和Mg
【答案】B
【解析】
根据n=![]() 可知11.2L氯气的物质的量为n(Cl2)=
可知11.2L氯气的物质的量为n(Cl2)=![]() mol=0.5mol,金属与氯气反应时,氯元素由0价降为-1价,消耗氯气0.5mol,则转移电子0.5mol×2=1mol,由题意25g合金转移1mol电子;可用极值法进行判断,即消耗0.5mol氯气需要单一金属的质量,两种金属的质量必须满足一个大于25g,一个小于25g;
mol=0.5mol,金属与氯气反应时,氯元素由0价降为-1价,消耗氯气0.5mol,则转移电子0.5mol×2=1mol,由题意25g合金转移1mol电子;可用极值法进行判断,即消耗0.5mol氯气需要单一金属的质量,两种金属的质量必须满足一个大于25g,一个小于25g;
A. 1mol钠与氯气反应生成氯化钠,转移1mol电子需要1mol钠即23g;1mol镁24g与氯气反应生成氯化镁,转移2mol电子,转移1mol电子需要12g镁,转移1mol电子所需的钠和镁的质量均小于25g,该合金的组合不可能,故A错误;
B. 1mol铜64g与氯气反应生成氯化铜,转移2mol电子,转移1mol电子需要32g铜;1mol钙40g与氯气反应生成氯化钙,转移2mol电子,转移1mol电子需要20g钙,转移1mol电子所需的铜和钙的质量一个大于25g,一个小于25g,该合金的组合是可能的,故B正确;
C. 1mol铜64g与氯气反应生成氯化铜,转移2mol电子,转移1mol电子需要32g铜;1mol锌65g与氯气反应生成氯化锌,转移2mol电子,转移1mol电子需要32.5g锌,转移1mol电子所需的铜和锌的质量都大于25g,该合金的组合是不可能的,故C错误;
D. 1mol铁56g与氯气反应生成氯化铁,转移3mol电子,转移1mol电子需要约为18.7g铁;1mol镁24g与氯气反应生成氯化镁,转移2mol电子,转移1mol电子需要12g镁,转移1mol电子所需的铁和镁的质量都小于25g,该合金的组合是不可能的,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】(1)X原子在第二电子层上只有一个空轨道,则X是__;其轨道表示式为__;R原子的3p轨道上只有一个未成对电子,则R原子可能是__、 ;Y原子的核电荷数为29,其电子排布式是__,其在元素周期表中的位置是__,是属于__区的元素。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:__、__、__。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子__。![]()
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)__。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4__H2SO3;H3PO4__H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为__杂化,分子的立体构型为__。
BF3分子中,中心原子的杂化方式为__杂化,分子的立体构型为__。
(7)H2O的沸点(100℃)比H2S的沸点(﹣61℃)高,这是由于________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(一) 现代铝的精炼研究方向是减低能耗。如图 :室温下通过电解在阴极沉积纯铝,A1Br3 在苯(简写 ArH)中可以生成[A12Br5ArH]+和 Br-。

(1)阳极的材料________;
(2)写出阴极沉积铝的电极方程式__________________________________________;
(二)邻硝基苯甲酸是重要的医院中间体,最新合成方法是邻硝基甲苯和高锰酸钾在相转移催化剂季铵盐(Q+X-)氧化、酸化合成,其原理如下:

相转移催化原理如下:

有关物质的物理性质如下表:
物质 | 邻硝基苯甲酸 | 高锰酸钾 | 苄基三乙基氯化铵(C6H5-CH2CH2)N(C2H5)3Cl | 聚乙二醇 | 四丁基溴化铵(C4H9)4NBr | NH4Cl |
水 | 难溶 | 易溶 | 可溶 | 任意比互溶溶 | 可溶 | 易溶 |
有机物 | 易溶 | 难溶 | 易溶 | 易溶 | 易溶 | 难溶 |
下列说法不合理的是________;
A.相转移催化剂作用主要决定于 Q+的物理化学性质
B.反应中为了防止温度剧烈升高,投料应该分批加入
C.Q+X-是通过增大反应接触面积提高反应速率
D.增大压强可以提高邻硝基甲苯氧化的反应限度
E.工业使用季铵盐(Q+X-)可以提高邻硝基苯甲酸产率
(2)四丁基溴化铵(C4H9)4NBr 萃取水中的高锰酸钾的方程式为:KMnO4(aq) +Q+X-(aq) →Q+ MnO4- (aq) +KX(aq),写出平衡常数 k 的表达式________________;设n(Q+X-):n(邻硝基甲苯)=x,理论证明当 x=5%邻硝基甲酸产率 y 得到最大值,请画出 y 随 x 变化的示意图________________ 。
(3)实验表明,当温度 100℃、反应时间 2.5h,n(KMnO4): n(邻硝基甲苯)=3:1,催化剂用量相同,Q+X-反应的催化效果如下:
相转移催化剂 | 苄基三乙基氯化铵 (C6H5-CH2CH2) N(C2H5)3Cl | 聚乙二醇 | 四丁基溴化铵 (C4H9)4NBr |
产率% | 46.7 | 20.0 | 53.1 |
苄基三乙基氯化铵比四丁基溴化铵催化效果差的原因_____________________________;工业生产不用聚乙二醇做催化剂的主要原因____________________________________ ;
(4)(C4H9)4NBr 为催化剂,邻硝基甲苯和高锰酸钾反应,测得溶液酸碱性对产率、反应时间影响如图 ,下列推测合理的是________。

A.溶液碱性强产率降低是因为季铵盐发生水解反应
B.pH=2 高锰酸钾一定发生副反应
C.选择 pH=7、适当升温可以提高产率
D.工业可以选择浓硝酸替代高锰酸钾做氧化剂,减缓对设备的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氯的物质与人们的生活密切相关。已知氯元素常见的化合价有-1、0、+1、+3、+5、+7六种,其不同价态的物质间可相互转化。回答下列问题:
(1)氯原子的原子结构示意图___;氯离子的电子式___。
(2)氯气能使湿润的有色布条褪色,起到漂白作用的物质是____(写名称),漂粉精的主要有效成分是___(写化学式)。
(3)实验室制取氯化氢的化学方程式____。
(4)工业上将含有氯气的尾气通过___进行处理,在处理时发生的反应中氯气作为____。
a.氧化剂 b.还原剂 c.既是氧化剂又是还原剂 d.既不是氧化剂又不是还原剂
(5)写出氯气的两种用途____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。已知:HNO2既有氧化性又有还原性;AgNO2微溶于水,能溶于硝酸:AgNO2+HNO3= AgNO3+ HNO2。
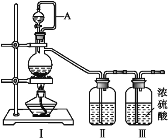
(1)利用Ⅰ、Ⅱ、Ⅲ装置制备原料气NO和Cl2
① 写出利用装置Ⅰ制备氯气的离子反应方程式:_________。
② 利用上述装置制备NO时,Ⅱ中盛装物质为_________(写化学式)。
(2)利用以下装置在常温常压下制备ClNO
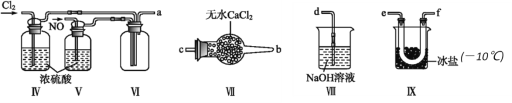
① 装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
② 为使NO和Cl2恰好完全反应生成ClNO,理论上通入NO和Cl2两种气体的流速比为_________。
③ 装置Ⅸ的作用是_____________。
④ 装置Ⅷ吸收尾气时,有同学认为尾气中的某种气体不能完全被吸收,为了充分吸收尾气,可将尾气与______________(气体)同时通入NaOH溶液中。
⑤ 王水是浓盐酸和浓硝酸的混酸,一定条件下混酸可生成ClNO和Cl2,该反应的化学方程式为______________________________________。
⑥ 写出验证ClNO与H2O完全反应后的溶液中存在Cl-和HNO2的实验步骤:取少量反应后的溶液于试管中,______________________________________________________。(限选试剂如下:AgNO3溶液,稀硝酸,KMnO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如下图所示。据图判断错误的是( )

A. a的数值一定大于9
B. Ⅱ为氨水稀释时溶液的pH变化曲线
C. 稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D. 完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积:V(NaOH)<V(氨水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积均为100mL浓度均为1molL的 NaClO、NaOH、CH3COONa的三种溶液中通入CO2,测得各溶液中n(HCO3-)的变化如下:

下列分析正确的是
A. CO2通入 NaClO溶液的反应:2ClO-+CO2+H2O=CO32-+2HClO
B. CO2通入 CH3COONa溶液的反应:CO2+H2O+ CH3COO-=HCO3-+ CH3COOH
C. 通入n(CO2)=0.06mol,NaOH溶液的反应:2OH-+CO2=CO32-+H2O
D. 通入n(CO2)=0.06mol,三种溶液中:n(HCO3-)+n(CO32-)+n(H2CO3)=0.06mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图可设计成多种用途的电化学装置,下列说法错误的是

A. a与电源正极相连时,铜做阳极
B. a和b用导线连接时,锌做负极
C. a和b用导线连接时,铜片上发生的反应为:2H++2e -=H2↑
D. a与电源正极相连可以保护锌片,称为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁可用作燃料的节能消烟剂、抗爆剂等。实验室制备二茂铁装置示意图如图一
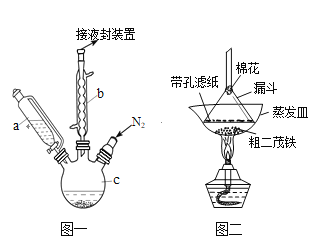
已知:①二茂铁熔点是173℃,在100℃时开始升华;沸点是249℃。
②制备二茂铁的反应原理是:2KOH+FeCl2+2C5H6= Fe(C5H5)2+2KCl+2H2O
实验步骤为:
①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a中加入60mL无水乙醚到烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a滴入5.5mL新蒸馏的环戊二烯(C5H6, 密度为0.95g/cm3),搅拌;
③将6.5g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25mL装入仪器a中,慢慢滴入仪器c中,45min滴完,继续搅拌45min;
④再从仪器a加入25mL无水乙醚搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b的名称是________________________.
(2)步骤①中通入氮气的目的是____________________________________________________.
(3)仪器c的适宜容积应为(选编号):_________
①100mL ②250mL ③500mL
(4)步骤⑤用盐酸洗涤的目的是__________________________________________________
(5)步骤⑦是二茂铁粗产品的提纯,该过程在图二中进行,其操作名称为_________;该操作中棉花的作用是______________________________________________________.
(6)为了确认得到的是二茂铁,还需要进行的一项简单实验是__________________________;若最终制得纯净的二茂铁4.3g,则该实验的产率为____________(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com