
 NH3:3H•+
NH3:3H•+ →
→ .
. 科目:高中化学 来源: 题型:解答题
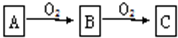
 2SO3.
2SO3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
 ;
; +HNO3$→_{50~60℃}^{浓硫酸}$
+HNO3$→_{50~60℃}^{浓硫酸}$ +H2O,反应类型取代反应.
+H2O,反应类型取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
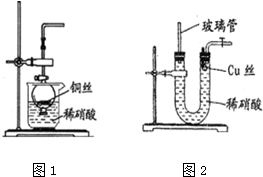
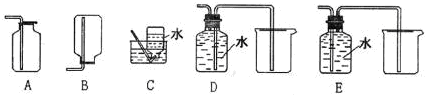
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| B. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++Cu═Fe2++Cu2+ | |
| D. | 明矾溶液与足量的氢氧化钡溶液混合:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硝酸 | Na2S | AgNO3与 AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓硫酸 | 无水 乙醇 | 溴水 | 有乙烯生成 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
| D | 稀硫酸 | Na2CO3 | Na2SiO3 溶液 | 酸性: 稀硫酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
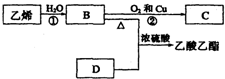 已知乙烯能发生以下转化:
已知乙烯能发生以下转化:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com