
| A. | 氨气通入醋酸中:CH3COOH+NH3═CH3COO-+NH4+ | |
| B. | 向碳酸氢镁溶液中加过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ | |
| C. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
分析 A.二者反应生成醋酸铵;
B.向碳酸氢镁溶液中加过量石灰水反应生成碳酸钙和氢氧化镁;
C.澄清石灰水应拆成离子形式;
D.二者不反应.
解答 解:A.氨气通入醋酸中:CH3COOH+NH3═CH3COO-+NH4+,故A正确;
B.碳酸氢镁溶液中加过量澄清石灰水,反应的离子方程式为:Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+2H2O+Mg(OH)2↓,故B错误;
C.澄清石灰水与稀盐酸反应,离子方程式:OH-+H+═H2O,故C错误;
D.稀硫酸滴在铜片上不发生反应吗,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,题目难度不大.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:填空题
 物质结构决定物质性质.回答下列问题:
物质结构决定物质性质.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 29:8:13 | B. | 22:1:14 | C. | 13:8:13 | D. | 26:16:13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CCl4中的溶解性Cl2<BrCl<Br2 | |
| B. | BrCl氧化性比Br2强 | |
| C. | BrCl能使润湿的淀粉碘化钾试纸变蓝 | |
| D. | 常温下BrCl可与NaOH溶液反应生成NaClO和NaBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
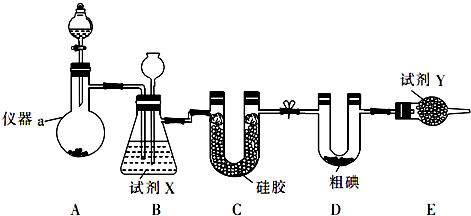
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
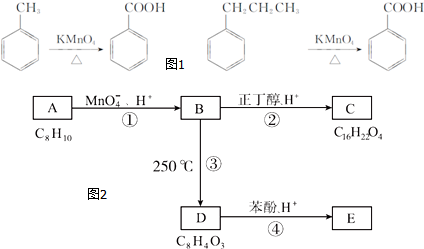
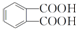 .
.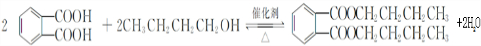 ,该反应的类型为取代反应.
,该反应的类型为取代反应.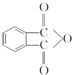 ,在D物质的核磁共振氢谱图中,会出现2组峰,峰面积之比为1:1.
,在D物质的核磁共振氢谱图中,会出现2组峰,峰面积之比为1:1.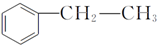 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | |
| B. | Mg2+的结构示意图: | |
| C. | CO2的电子式: | |
| D. | 熔融状态下硫酸氢钾的电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$K++H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com