
【题目】常温下向 0.l mol/L 的NaClO 溶液中通入 HF 气体,随反应进行(不考虑HClO分解),溶液中lg![]() ( A 代表ClO 或F) 的值和溶液pH 变化存在如图所示关系,下列说法正确的是
( A 代表ClO 或F) 的值和溶液pH 变化存在如图所示关系,下列说法正确的是
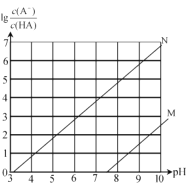
A.线N 代表lg![]() 的变化线
的变化线
B.反应ClO-+HF HCIO+F- 的平衡常数数量级为 105
C.当混合溶液pH= 7 时,溶液中c(HClO) = c(F- )
D.随HF 的通入,溶液中c(H+) c(OH- )增大
【答案】C
【解析】
![]() ,
,![]() ,由于同浓度酸性:HF大于HClO,当lg
,由于同浓度酸性:HF大于HClO,当lg![]() =0时,则
=0时,则![]() =1,则K(HF)=10-3.2,K(HClO)=10-7.5。
=1,则K(HF)=10-3.2,K(HClO)=10-7.5。
A.![]() ,
,![]() ,由于同浓度酸性:HF大于HClO,又因lg
,由于同浓度酸性:HF大于HClO,又因lg![]() =0时,则
=0时,则![]() =1,因此pH大的为HClO,所以线M代表
=1,因此pH大的为HClO,所以线M代表![]() 的变化线,故A错误;
的变化线,故A错误;
B.反应ClO- + HF ![]() HClO+F-的平衡常数
HClO+F-的平衡常数![]() ,其平衡常数数量级为104,故B错误;
,其平衡常数数量级为104,故B错误;
C.当混合溶液pH= 7 时,根据电荷守恒c(Na+) + c (H+) = c(ClO-) + c(F-) + c(OH-),溶液呈中性,得到c(Na+) = c(ClO-) + c(F-),根据物料守恒c(ClO-) +c(HClO) = c(Na+),因此溶液中c(HClO)= c(F-),故C正确;
D.温度未变,随HF的通入,溶液中c(H+)c(OH-)不变,故D错误。
综上所述,答案为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是

A.W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)=0.1 mol·L-1
C.pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)
D.pH=11的溶液中:c(Na+)+ c(H+)=c(OH-)+c(Cl-)+ c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对所给的8种元素,完成下列小题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)元素①的元素符号是__________, 元素⑤的原子结构示意图为____________。
(2)元素②的简单氢化物的化学式为__________,此氢化物遇元素⑧的氢化物时,会产生大量的____________(填现象)
(3)题目所给的8种元素中,金属性最强的元素是___________(填元素名称),非金属性最强的元素是_______(填元素名称),最高价氧化物对应水化物具有两性的是_______(填化学式,下同),最高价氧化物对应水化物碱性最强的是________,元素②和③的简单氢化物较稳定的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.氨水中加酸,NH4+的浓度增大
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨控制在500℃左右的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尖晶石是世界上最迷人的宝石之一,主要是镁铝氧化物组成的矿物,还常含有铁、锌、锰、铬、钴等元素。回答下列问题:
(1)基态锰原子价层电子排布式为__________,Co3+的未成对电子数为_________。
(2)一种铝试剂的结构如图,该物质中碳的杂化类型为___________,氮与其成键的3个原子共同构成的空间构型为_______,氮与铝形成的是_____键(填编号。)
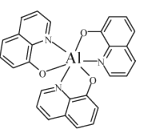
a离子b配位c.σd.π
(3)基态原子第一电离能:镁_____铝(填“大于”“小于”或“等于”)原因是_______。
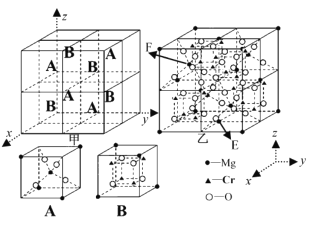
(4)一种由Mg、Cr、O元素组成的尖晶石晶胞分别由4个A与4个B交替无隙并置而成(见图甲),晶胞结构如图乙所示,该尖晶石的化学式为_____________;图乙中,若E点镁原子的分数坐标为(![]() ,
,![]() ,0),则F点镁原子的分数坐标为_______________。
,0),则F点镁原子的分数坐标为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四组实验描述不正确的是
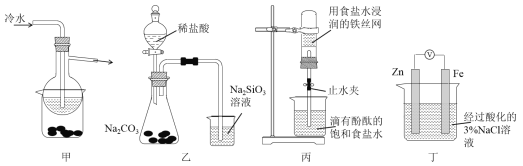
A. 加热甲装置中的烧杯可以分离SiO2和NH4Cl
B. 利用装置乙可证明非金属性强弱:Cl>C>Si
C. 打开丙中的止水夹,一段时间后,可观察到烧杯内溶液上升到试管中
D. 向丁中铁电极区滴入2滴铁氰化钾溶液,一段时间后,烧杯中不会有蓝色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e五种短周期元素的原子半径与原子序数的关系如下图,下列说法错误的是( )
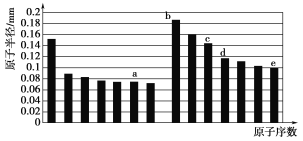
A. a、e两种元素的气态氢化物的沸点相比,前者较高
B. c、e两种元素的离子半径相比,前者较小
C. 由a与d两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. c的氧化物能溶于b的氢氧化物的水溶液和e的氢化物的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁(FePO42H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁.
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤.反应加热的目的是_____.
(2)向滤液中加入一定量H2O2氧化Fe2+,为使滤液中的Fe2+完全被H2O2氧化成Fe3+,下列实验条件控制正确的是_____(填字母编号).
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行 D.用氨水调节溶液pH=7
(3)往含有Fe3+的溶液中加入一定量的Na2HPO4溶液(溶液显碱性),搅拌、过滤、洗漆、干燥得到FePO42H2O.若反应得到的FePO42H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为_____.
(4)实验过程中用H2O2氧化Fe2+之前,为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式为:CrO![]() +6Fe2++14H+═2Cr3++6Fe3++7H2O
+6Fe2++14H+═2Cr3++6Fe3++7H2O
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、_____和_____.
②若滴定x mL含Fe2+的滤液消耗a molL﹣1K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=_____ molL﹣1.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com