
����Ŀ���⾧ʯ�������������˵ı�ʯ֮һ����Ҫ��þ����������ɵĿ��������������п���̡������ܵ�Ԫ�ء��ش��������⣺
��1����̬��ԭ�Ӽ۲�����Ų�ʽΪ__________��Co3+��δ�ɶԵ�����Ϊ_________��
��2��һ�����Լ��Ľṹ��ͼ����������̼���ӻ�����Ϊ___________��������ɼ���3��ԭ�ӹ�ͬ���ɵĿռ乹��Ϊ_______���������γɵ���_____�������š���
a����b��λc.��d.��
��3����̬ԭ�ӵ�һ�����ܣ�þ_____��������ڡ���С�ڡ����ڡ�)ԭ����_______��
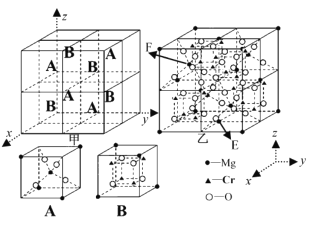
��4��һ����Mg��Cr��OԪ����ɵļ⾧ʯ�����ֱ���4��A��4��B������϶���ö��ɣ���ͼ�ף��������ṹ��ͼ����ʾ���ü⾧ʯ�Ļ�ѧʽΪ_____________��ͼ���У���E��þԭ�ӵķ�������Ϊ(![]() ��
��![]() ��0)����F��þԭ�ӵķ�������Ϊ_______________��
��0)����F��þԭ�ӵķ�������Ϊ_______________��
���𰸡�3d54s2 4 sp2 ƽ�������� bc ���� þԭ�ӵ����Ų�Ϊȫ���䣩�����ȶ��ṹ����þԭ��Ϊ 3s2 ȫ�����ṹ����ʧ���ӣ�����ʧȥ 1 ������Ϊ 3s2��ȫ�����ȶ��ṹ��þԭ��ʧȥ 1 ������Ϊ3s1���ȶ��ṹ��������һ�ִ� MgCr2O4��Cr2MgO4Ҳ�ɣ� ��![]() ��
��![]() ,
,![]() ��
��
��������
�Ż�̬����25��Ԫ�أ����̬ԭ�ӵ����Ų�ʽΪ[Ar]3d54s2�� Co��27��Ԫ�أ����̬ԭ�ӵ����Ų�ʽΪ[Ar]3d74s2��Co3+�����Ų�ʽΪ[Ar]3d6��
�Ƹ�������̼�۲���Ӷ���Ϊ3�ԣ�������ɼ���3��ԭ�ӣ���۲���Ӷ���Ϊ3�������ṹ��δ�����γɼ�ʱ����1�Թ¶Ե��ӣ������γ�ʱ���ṩ�¶Ե��ӡ�
��þԭ��Ϊ3s2��ȫ�����ṹ����ʧ���ӣ���ԭ��3s23p1����ʧȥ1�����ӱ�Ϊ3s2��ȫ�����ȶ��ṹ��
���ȼ���ÿ��A��Mg��O�������ټ���B��O��Mg��Cr�������ٵó�������������Mg��O��Cr�������ٵû�ѧʽ��F��þԭ������ǰ�Ϸ���С�����������ġ�
�Ż�̬����25��Ԫ�أ����̬ԭ�ӵ����Ų�ʽΪ[Ar]3d54s2���۲�����Ų�ʽΪ3d54s2��Co��27��Ԫ�أ����̬ԭ�ӵ����Ų�ʽΪ[Ar]3d74s2��Co3+�����Ų�ʽΪ[Ar]3d6��δ�ɶԵ�����Ϊ4���ʴ�Ϊ��3d54s2��4��
����ͼ�ṹ����������̼�۲���Ӷ���Ϊ3�ԣ����ӻ�����Ϊsp2��������ɼ���3��ԭ�ӣ���۲���Ӷ���Ϊ3����˵�����ɼ���3��ԭ�ӹ�ͬ���ɵĿռ乹��Ϊƽ�������Σ������ṹ��δ�����γɼ�ʱ����1�Թ¶Ե��ӣ������γ�ʱ���ṩ�¶Ե��ӣ�����γɵ�����λ�����������ʴ�Ϊ��sp2��ƽ�������Σ�bc��
��þԭ��Ϊ3s2��ȫ�����ṹ����ʧ���ӣ���ԭ��3s23p1����ʧȥ1�����ӱ�Ϊ3s2��ȫ�����ȶ��ṹ����˻�̬ԭ�ӵ�һ�����ܣ�þ���������ʴ�Ϊ�����ڣ�þԭ�ӵ����Ų�Ϊȫ(��)�����ȶ��ṹ����þԭ��Ϊ3s2ȫ�����ṹ����ʧ���ӣ�����ʧȥ1������Ϊ3s2��ȫ�����ȶ��ṹ��þԭ��ʧȥ1������Ϊ3s1���ȶ��ṹ(����һ�ִ�)��
��A��MgΪ1.5����OΪ4����B��OΪ4����MgΪ0.5����CrΪ4���������ṹ��ͼ����ʾ�����������������MgΪ16����OΪ32����CrΪ16������˸ü⾧ʯ�Ļ�ѧʽΪMgCr2O4��ͼ���У���E��þԭ�ӵķ�������Ϊ(![]() ��
��![]() ��0)����F��þԭ������ǰ�Ϸ���С�����������ģ����������Ϊ(
��0)����F��þԭ������ǰ�Ϸ���С�����������ģ����������Ϊ(![]() ��
��![]() ��
��![]() )���ʴ�Ϊ��MgCr2O4��(
)���ʴ�Ϊ��MgCr2O4��(![]() ��
��![]() ��
��![]() )��
)��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������ȷ���ǣ���
A.![]() 1��3��4-���ױ�
1��3��4-���ױ�
B.![]() 3-����ϩ
3-����ϩ
C.![]() 2-��-1-����
2-��-1-����
D.![]() 1��3-�������
1��3-�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��Ԫ�ص�ԭ��R��Aԭ�ӽ���γ�RA3��̬���ӣ�������ṹ�������Ρ�RCl5����̬��Һ̬ʱ�����ӽṹ��ͼ��ʾ�����й���RCl5���ӵ�˵������ȷ���ǣ� ��
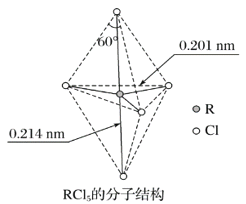
A. ÿ��ԭ�Ӷ��ﵽ8�����ȶ��ṹ
B. ����(Cl��R��Cl)��90����120����180������
C. RCl5���Ⱥ��ֽ����ɷ���RCl3��RCl5��RCl3���Ǽ��Է���
D. ������5��R��Cl�����ܲ���ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ù���ȼ�ϵ�ؼ������� H2S�����������ԭ����ͼ��ʾ �����ݲ�ͬ��������M�����ӵIJ�ͬ����Ϊ���Ӵ����ͺ������Ӵ�����,�����¶ȷֱ�Ϊ 500��� 850�����ң���������ʱ�IJ������ʾΪSx������˵���������
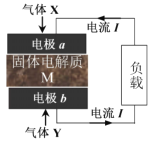
A.����X ��H2S����������Y �ǿ���
B.M��������ʱ������a ��ӦΪ��xH2S��2xe-=Sx+2xH+
C.M����������ʱ�����ڲ���SO2��Ⱦ�������
D.������Ǩ�Ʒ����Ǵ�a �缫��b �缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������� 0.l mol/L ��NaClO ��Һ��ͨ�� HF ���壬�淴Ӧ���У�������HClO�ֽ⣩����Һ��lg![]() ( A ����ClO ��F) ��ֵ����ҺpH �仯������ͼ��ʾ��ϵ������˵����ȷ����
( A ����ClO ��F) ��ֵ����ҺpH �仯������ͼ��ʾ��ϵ������˵����ȷ����
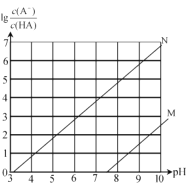
A.��N ����lg![]() �ı仯��
�ı仯��
B.��ӦClO-+HF HCIO+F- ��ƽ�ⳣ��������Ϊ 105
C.�������ҺpH= 7 ʱ����Һ��c(HClO) = c(F- )
D.��HF ��ͨ�룬��Һ��c(H+) c(OH- )����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
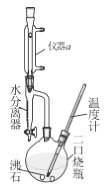
����Ŀ�������ѿ��������л�����ܼ�����ȡ�� �������ڵ��Ӽ���ϴ���������л��ϳ� ��ʵ��������������ŨH2SO4��Ӧ��ȡ��ʵ��װ������ͼ��������г�װ����ȥ����Ӧԭ�����й����ݣ�
��Ӧԭ���� 2C4H9OH ![]() C4H9OC4H9+H2O
C4H9OC4H9+H2O
����Ӧ��C4H9OH![]() C2H5CH=CH2+H2O
C2H5CH=CH2+H2O
���� | ��Է������� | �۵�/�� | �е�/�� | �ܽ��� | ||
ˮ | 50%���� | ���� | ||||
������ | 74 | -89.8 | 117.7 | �� | ���� | ������ |
������ | 130 | -98 | 142.4 | ���� | �� | |
ʵ�鲽�����£�
���ڶ�����ƿ�м���0.34mol��������4.5mLŨH2SO4,�ټ���С����ʯ��ҡ�ȡ�
�ڼ��Ƚ��裬�¶�������100~ll0�濪ʼ��Ӧ�����ŷ�Ӧ�Ľ��У���Ӧ�в�����ˮ���������ռ���ˮ���������²㣬�ϲ��л�����ˮ������֧��ʱ�����ɷ�����ƿ����������Ӧ��ɡ�
�۽���ӦҺ��ȴ��������ˮ��50%����ϴ�ӡ�ˮϴ�ӣ�������ˮ�Ȼ��Ƹ�����ˣ����������ѵ�����ΪWg��
��ش�
��1���Ʊ������ѵķ�Ӧ������____________������a��������_________��
��2���������ҩƷ������˳���ǣ��ȼ�______�������������ŨH2SO4��������ʯ��������___________________��
��3���������Ϊ���ٸ���Ӧ�������¶�Ӧ������_________��Ϊ�ˡ�ʹ��ˮ���������Ϸ����ˮ��Ŀ����________������жϷ�Ӧ�Ѿ���ɣ���_____ʱ��������Ӧ��ɣ�����ֹͣʵ�顣
��4�����������50%����ϴ�ӵ�Ŀ����Ϊ�˳�ȥ______________����ʵ���У������ѵIJ���Ϊ_____���г���W�ı���ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�������ú�������(��Ҫ�ɷ�ΪNiO������Fe2O3��CaO��CuO��BaO��)��������Ա������һ�ֻ��������¹��ա�����������ͼ��
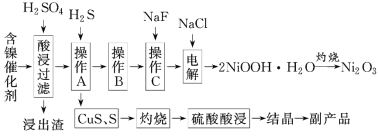
��֪���ٳ������й��������↑ʼ�����ͳ�����ȫʱ��pH���±���ʾ��
�������� | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
��ʼ������pH | 1.5 | 6.5 | 7.7 |
������ȫ��pH | 3.7 | 9.7 | 9.2 |
��Cu2O+2H+=Cu+Cu2++H2O
�۳���ʱ��Ksp(CaF2)=2.7��10-11
�ش��������⣺
��1��д�����ʱFe2O3�����ᷴӦ�Ļ�ѧ����ʽ��__��
��2����������Ҫ�ɷ�ΪCaSO4��2H2O��__�������ʡ�
��3������B�dz�ȥ��Һ�е���Ԫ�أ�ijͬѧ��������·����������A���õ���Һ�м���NaOH��Һ��������ҺpH��3.7��7.7��Χ�ڣ����ã����ˡ���Ը�ʵ������������۲�˵�����ɣ�__(��ԭ������ȷ����˵�����ɣ���ԭ������������Ը���)��
��4�������е�������Ʒ��Ϊ__(�ѧʽ)���ڿ���������CuS���Եõ�ͭ���������Cu��Cu2O��CuO��ɵĻ�����м���1L0.6mol��L-1HNO3��Һǡ��ʹ������ܽ⣬ͬʱ�ռ���2240mLNO����(��״����)�����û�����к�0.1molCu����ϡ�����ַ�Ӧ��������__molH2SO4��
��5������C��Ϊ�˳�ȥ��Һ�е�Ca2+����������Һ��F-Ũ��Ϊ3��10-3mol��L-1������Һ��![]() =__��
=__��
��6��������2NiOOH��H2O��ԭ����������
�ټ��������£�Cl-������������ΪClO-������1molClO-������OH-__mol��
��Ni2+��ClO-��������2NiOOH��H2O��������ò���Ӧ�����ӷ���ʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ؿ����ڵ���ⲿ���ڵ������Һ���Ӷ�ά�ֵ���ڲ��������ҺŨ���ȶ���ԭ����ͼ������˵����������
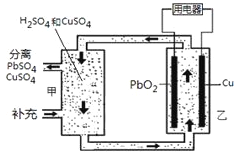
A��Cu����
B��PbO2�缫�ĵ缫��ӦʽΪ��PbO2+ 4H++ SO42��+ 2e��= PbSO4+ 2H2O
C������Ӧ��������
D��������1 mol PbO2��������2 mol CuSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���ʵ�������л���֮���ת������ѡ�Լ���ȷ����( )
ѡ�� | ����ת�� | �Լ� |
A |
| �������� |
B |
|
|
C |
| Ũ�����Ũ����Ļ����Һ |
D |
| ������Ȼ�̼��Һ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com