
| A. | Ca:1s22s22p63s23p63d2 | B. | Cu:3d94s2 | ||
| C. | Fe:3d64s2 | D. | C:1s22s12p3 |
分析 核外电子排布时要遵循能量最低原理、洪特规则、保里不相容原理,电子能量大小顺序是1s<2s<2p<3s<3p<4s<3d等,原子轨道中电子处于全满、全空、半满时最稳定,根据构造原理来分析解答.
解答 解:A.根据能量最低原理知,应该先排4s电子后排3d电子,则Ca基态原子的电子排布为1s22s22p63s23p64s2,故A错误;
B.当原子轨道中电子处于全满、半满或全空时最稳定,则Cu的价电子排布为3d104s1,故B错误;
C.根据能量最低原理知,应该先排4s电子后排3d电子,则Fe原子的价电子排布为3d64s2,故C正确;
D.根据能量最低原理知,应该先排2s电子后排2p电子,则C基态原子的电子排布为1s22s22p2,故D错误;
故选C.
点评 本题考查了原子核外价电子排布式,根据能量最低原理、洪特规则、保里不相容原理等知识点来分析解答,注意结合交错现象分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 降低压强能加快化学反应速率 | |
| B. | 使用适当催化剂可以加快化学反应速率 | |
| C. | 升高温度能加快化学反应速率 | |
| D. | 增大压强可以加快此反应的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素等高分子化合物均属于纯净物 | |
| B. | 金属氧化物都是碱性氧化物 | |
| C. | 食醋、纯碱、食盐分别属于酸、碱、盐 | |
| D. | 丁达尔效应可用于区别溶液与胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于电负性很大的元素 | B. | 属于第n周期元素 | ||
| C. | 属于第ⅢA(主族)元素 | D. | 属于p区元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
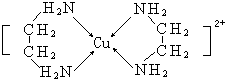
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g CH4中含有的原子总数为5NA | |
| B. | 78g苯含有碳碳双键的数目为3NA | |
| C. | 1mol/L NaCl溶液中含有的氯离子数目为NA | |
| D. | 标准状态下,11.2L CH3COOH中含有的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
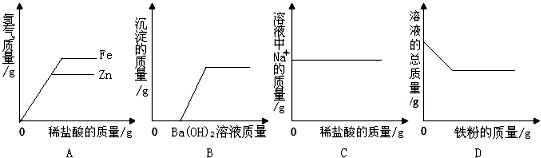
| A. | 将等质量的锌片和铁片分别加入足量的等质量等质量分数的稀盐酸中 | |
| B. | 向盐酸与硫酸钠混合溶液中加入氢氧化钡溶液 | |
| C. | 向一定量的氢氧化钠溶液中滴加稀盐酸 | |
| D. | 向一定量的硫酸铜溶液中加入铁粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com