
【题目】下列分析正确的是
A. 异丁烷的二氯代物有4种
B. 区别蛋白质和淀粉可用浓硝酸做颜色反应
C. 石蜡油分解产物均能使酸性KMnO4溶液褪色
D. 甲苯的硝化反应方程式为: ![]()
【答案】B
【解析】A项,异丁烷为CH3CH(CH3)CH3,其二氯代物中,取代同一碳原子上的2个H原子有:CH3CH(CH3)CHCl2;取代不同碳原子上的2个H原子有:ClCH2CH(CH3)CH2Cl,ClCH2CCl(CH3)CH3,所以共有3种,故A错误;B项,浓硝酸可与蛋白质发生颜色反应,显黄色,而淀粉不具有这样的性质,所以可用浓硝酸做颜色反应来区别蛋白质和淀粉,故B正确;C项,石蜡油分解的产物主要是烯烃和烷烃的混合物,烯烃能使酸性KMnO4溶液褪色,而烷烃不能使酸性KMnO4溶液褪色,故C错误;D项,甲苯的硝化反应为:甲苯、浓硝酸与浓硫酸共热至55℃~60℃,生成硝基苯和水,所以甲苯的硝化反应需要浓硫酸而不是稀硫酸,故D错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铝与过量的稀盐酸反应,为了加快反应速率,同时几乎不影响生成的氢气总量,不可以采取的措施是( )
A.加热,升高溶液温度
B.加入适量的水
C.加入少量CuSO4溶液
D.加入浓度较大的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如下。
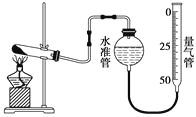
部分实验步骤:
①装好实验装置。
② 。
③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为m g。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热。
⑥测量收集到的气体体积。
⑦准确称量试管和残留物的质量为n g。
⑧测量实验室的温度。
回答下列问题。
(1)实验步骤的第②步是 ________________________________________________。
(2)测量收集到的气体体积,应注意的事项有:
①_____________________________________________________________________;
②_____________________________________________________________________;
③视线与凹液面最低处相平。
(3)如果实验中得到的氧气体积是p L,水蒸气的影响忽略不计,则室温下气体摩尔体积的计算式为__________(含m、n、p)。
(4)假定其他操作均正确,未恢复至室温就读数会导致实验结果___________________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.金属元素的原子只有还原性,其阳离子只有氧化性
B.O2与O3互为同位素,相互转化为化学变化
C.1H、2H、3H互为同位素,其性质相似
D.金属阳离子被还原不一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某科研小组利用废铁屑还原浸出软锰矿(主要成分为MnO2)制备硫酸锰及电解其溶液制锰的工艺流程图:

已知:①浸出液中主要含有Fe3+、Fe2+、Co2+、Ni2+等杂质金属离子;
②生成氢氧化物的pH见下表:
物质 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
开始沉淀pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
完全沉淀pH | 9.7 | 3.7 | 8.4 | 8.2 | 9.8 |
请回答下列问题:
(1)“酸浸”前将原料粉碎的目的是______________。
(2)流程图中“①加入MnO2”的作用是将浸出液中的Fe2+氧化为Fe3+,同时自身被还原为Mn2+。该反应的离子方程式是_________,其中的MnO2可以用试剂_____(填化学式)代替。
(3)流程图中“②调节pH”可以除去某种金属离子,应将溶液pH调节控制的范围是_________下列可用于流程中调节pH的试剂是__________(填试剂对应的字母编号)。
a.MnCO3 b.Na2CO3 C.NaOH d.氨水
(4)向滤液I中加人MnS的作用是除去Co2+、Ni2+等离子,发生反应为MnS+Ni2+=NiS+Mn2+等。当该反应完全后,滤液2中的Mn2+与Ni2+离子的物质的量浓度之比是_______[已知Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21]。
(5)上述流程中,能循环使用的一种物质是___________(填化学式)。
(6)上述流程中在电解前需对电解液中Mn2+的含量进行测定。方法是:取出一定体积的电解液,加入一定质量的NaBiO3(不溶于水),使二者发生反应,反应的氧化产物和还原产物分别是MnO4-、Bi3+。该反应的离子方程式是_______________。
(7)在适当条件下,在MnSO4=H2SO4+H2O为体系的电解液中电解也可获得MnO2,其阳极电极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中,不存在单双键交替结构可以作为证据的事实是
①苯不能使酸性高锰酸钾溶液褪色
②苯能在一定条件下跟氢气发生加成反应生成环己烷
③经实验测得邻二甲苯(![]() )只有一种结构
)只有一种结构
④苯在FeBr3存在下同液溴可发生取代反应,但不随溴水褪色
A. ②③④ B. ①②④ C. ①③④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是
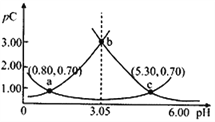
A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 常温下,pKa1(H2A)=5.30,pKa2(H2A)=0.80
C. b点时,![]() =104.50
=104.50
D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全满或半满。
(1)写出四种元素的元素符号。
A:________,B:________,C:________,D:________。
(2)写出C、D两种元素基态原子核外电子排布的电子排布图。
C:___________________________,D:_____________________________。
(3)写出B、C两种元素单质在一定条件下反应的化学方程式:____________。
(4)写出B元素单质和氢化物的电子式。单质:________,氢化物:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO是重要的燃料和工业原料。目前,对CO的综合利用是科学家研究的热点。回答下列问题:
Ⅰ.工业制备CO的方法之一是甲烷氧化法。
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802 kJ/mol
②2H2(g)+O2(g)=2H2O(g) △H=-484 kJ/mol
③2CO(g)+O2(g)=2CO2(g) △H=-330 kJ/mol
(1)反应2CH4(g)+O2(g)=2CO(g)+4H2(g),△H=_________kJ/mol。
Ⅱ.CO也是制备AlCl3的副产品
制备AlCl3的原理为:2Al2O3(s)+6Cl2(g) ![]() 4AlCl3(g)+3O2(g) △H1
4AlCl3(g)+3O2(g) △H1
(2)已知该反应在较低温度下不能自发进行,则△H1_____0(填“>”“<”或“=”)
(3)制备AlCl3的实际生产过程中,常加入足量的碳粉,同时生成CO(g)。T1℃时,向恒容的密闭容器中加入5molAl2O3(s)、14molC(s)和6.4molCl2(g)发生反应。Cl2(g)的浓度变化如图(a)所示;图b为20min后改变容器中条件,平衡体系的反应速率(![]() )随时间(t)的变化关系,且四个阶段都各改变一种不同条件(该条件下制得的AlCl3为固态)。
)随时间(t)的变化关系,且四个阶段都各改变一种不同条件(该条件下制得的AlCl3为固态)。

①容器中发生反应的化学方程式为______________________________。
②0~15min内,用CO表示的该反应平均速率![]() =__________mol/(Lmin)
=__________mol/(Lmin)
③T1℃时,该反应的平衡常数K=______________(不需带单位)。
④40min时的平衡常数[K(40)]与15min时的平衡常数[K(15)]的大小关系:K(40)____K(15)(填“>”“<”或“=”)
⑤45min时,改变的条件为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com